
��һ��Ԫ��X��Y��Z��W����������������������20��X��ԭ�Ӱ뾶��Ԫ������С�ģ�ZԪ�صķǽ�������Ԫ������ǿ�ģ�Yԭ�ӵ������ﵽ�ȶ��ṹ����ĵ�����ǡ�õ����ڲ�ĵ�������WԪ�ص�ԭ�ӽṹ�У�K�㡢L��ĵ�����֮�͵���M�㡢N��ĵ�����֮�͡�
�������ֺͻ�ѧ����ش��������⣺
��1�� X2Y������״�� ����____ ���ӣ�����ԡ��Ǽ��ԡ�����
��2���õ���ʽ��ʾ������WZ2���γɹ��� ��
XZ��X2Y�п�����������ܽ⣬ԭ���� ��
��3��д������ЩԪ����ɵ�����֮�䷢����һ���û���Ӧ ��
���������ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ���ũҵ������������������Ҫ���á���ش��������⣺
��ͼ��1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ ��
 â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

 2OH-+Cl2��+H2��
2OH-+Cl2��+H2�� 2OH-+Cl2��+H2��
2OH-+Cl2��+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Ԫ��X��Y��Z�����ڱ��е�λ����ͼ��ʾ��������˵��������ǣ�������
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | �й���Ϣ |
| X | Ԫ����Ҫ���ϼ�Ϊ-2 |
| Y | ��������������������������֮��Ϊ4 |
| Z | ��Xͬ���壬�䵥����X�ĵ�����ȼ�գ���������ɫ���� |
| D | ����������������ǿ����������ǿ�� |
| E | �����������г�������������Ʒ�ڳ�ʪ�Ŀ������ױ���ʴ���� |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

A�������ж�����Ԫ�����ʵ������ƶ�Ԫ�آ�����������Ӧ��ˮ���������ǿ
| |||||||||||||||||||||||||||
| B��ͼ�ױ�ʾZn-Cuԭ��ط�Ӧ�����еĵ���ǿ�ȵı仯��Tʱ���ܼ�����H2O2 | |||||||||||||||||||||||||||
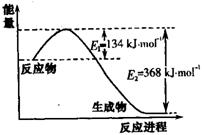
| C��ͼ�ұ�ʾijһ���ȷ�Ӧ����ʹ�ô���E1��E2����H���ᷢ���ı� | |||||||||||||||||||||||||||
| D��ͼ����ʾԪ�����ڱ���һ���֣�Ԫ��X��Y��Z��W��X���⻯��������ǿ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com