
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
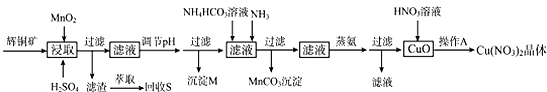
分析 辉铜矿主要含有硫化亚铜(Cu2S),还有Fe203、Si02及一些不溶性杂质,加入硫酸溶液及二氧化锰溶解浸取过滤,过滤得滤渣,萃取回收硫单质;在滤液中调节溶液的pH值,使铁离子沉淀而除去,所以沉淀M为氢氧化铁,过滤在滤液中加碳酸氢铵和氨气得碳酸锰沉淀,将滤液进行蒸氨、过滤得氧化铜,氧化铜中加入硝酸,经过蒸发浓缩、降温结晶得到硝酸铜晶体,
(1)反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,根据化合价升降相等配平;
(2)调节pH使铁离子沉淀,根据表中数据使铁离子溶液完全且不使铜离子沉淀判断pH值;
(3)锰离子与碳酸氢根离子在氨水中生成碳酸锰沉淀和铵根离子;
(4)根据上面的分析可知,操作A是从硝酸铜溶液中获得硝酸铜晶体,注意硝酸铜是受热能分解的物质,据此答题;
(5)根据反应①2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l,②2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l,利用盖斯定律可知,将(①+②)÷3即得Cu2S与02加热反应生成Cu的热化学方程式;
(6)根据铜元素守恒及n=$\frac{m}{M}$计算出硝酸铜的物质的量.
解答 解:辉铜矿主要含有硫化亚铜(Cu2S),还有Fe203、Si02及一些不溶性杂质,加入硫酸溶液及二氧化锰溶解浸取过滤,过滤得滤渣,萃取回收硫单质;在滤液中调节溶液的pH值,使铁离子沉淀而除去,所以沉淀M为氢氧化铁,过滤在滤液中加碳酸氢铵和氨气得碳酸锰沉淀,将滤液进行蒸氨、过滤得氧化铜,氧化铜中加入硝酸,经过蒸发浓缩、降温结晶得到硝酸铜晶体,
(1)根据工艺流程浸取时的反应:Cu2S+MnO2+H2SO4→MnSO4+CuSO4+H2O+S,根据化合价的升降配平,Cu2S整体升高4,MnO2下降2,最小公倍数4,MnO2和MnSO4的系数为2,Cu2S的系数为1,根据原子个数守恒,配平其他,反应的离子方程式为:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,
故答案为:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;
(2)调节pH使铁离子转化成氢氧化铁完全沉淀,根据表中数据使铁离子溶液完全,则3.2≤pH,且不使铜离子沉淀,则pH<4.4,所以pH值范围为:3.2≤pH<4.4,
故答案为:铁离子转化成氢氧化铁完全沉淀;3.2≤pH<4.4;
(3)锰离子与碳酸氢根离子在氨水中生成碳酸锰沉淀和铵根离子,反应的离子方程式为:Mn2++NH3+HCO3-=MnCO3↓+NH4+,
故答案为:Mn2++NH3+HCO3-=MnCO3↓+NH4+;
(4)根据上面的分析可知,操作A是从硝酸铜溶液中获得硝酸铜晶体,注意硝酸铜是受热能分解的物质,所以操作A为蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩、冷却结晶;
(5)根据反应①2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l,②2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l,利用盖斯定律可知,将(①+②)÷3即得Cu2S与02加热反应生成Cu的热化学方程式为:Cu2S(s)+02 (g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l ,
故答案为:Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l;
(6)1.6kg这样的辉铜矿含有Cu2S的质量为85%×1.6kg,根据铜元素守恒可知,能生成Cu(N03)2的物质的量为:$\frac{1600g×85%×95%×(1-3%)×(1-5%)}{160g/mol}$×2≈14.9mol,
故答案为:14.9mol.
点评 本题考查了制备方案的设计,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意掌握制备方案设计与评价的原则,试题知识点较多、综合性较强,充分培养了学生的分析、理解能力及化学实验、化学计算能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.0gSiO2晶体中存在的共价键总数为2 NA | |
| B. | 1L 0.1mol•L-1的Na2CO3溶液中含有阳离子的总数为2NA | |
| C. | 标准状况下,2.0gD2O中含有的质子数和中子数均为NA个 | |
| D. | 室温时,pH=12的Ba(OH)2溶液中,氢氧根离子数目为10-2N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中C的氢化物稳定性最强 | |
| B. | 同周期元素中A的金属性最强 | |
| C. | 原子半径:A>B,离子半径:A+>C- | |
| D. | A、B、C的简单离子中,会破坏水的电离平衡的是C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A所形成的氢化物常温下一定为气态 | |
| B. | 非金属性:A<E | |
| C. | 元素C、D、E在自然界中均不能以游离态存在 | |
| D. | 元素B的氧化物对应的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | 操作 | |
| A | 干燥Cl2 | 将气体通过盛有碱石灰的干燥装置 |
| B | 检验溴乙烷中的溴元素 | 取样,加NaOH溶液,振荡后再加AgNO3溶液 |
| C | 测定混有NaCl的Na2CO3固体样品中Na2CO3的质量分数 | 取m1g样品加入过量盐酸充分反应,加热蒸干后,称量固体质量为m2 g |
| D | 配制100mL 1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的原子序数一定为a+2 | |
| B. | Y离子的结构示意图可表示为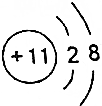 | |
| C. | 若b-a=6.则X和Y形成的化合物一定为离子化合物 | |
| D. | X有可能是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数:E>F | |
| B. | 等物质的量的E和F分别与足量稀盐酸反应,产生氢气的物质的量:E>F | |
| C. | Ea+和Fb+有相同的电子层结构(a<b) | |
| D. | 25℃时,Ksp[E(OH)a]>Ksp[F(OH)b] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com