
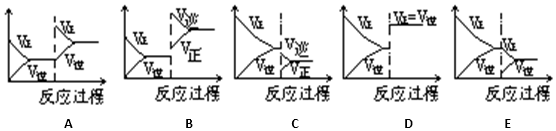
| 达到新的平衡对应的图象 (填写字母) | 平衡移动方向 (正反应、逆反应,不移动) | |
| (1)使用催化剂 | ||
| (2)升温 | ||
| (3)降压 | ||
| (4)增加A的量 | ||
| (5)减少C的量 |
分析 反应A(g)+B(g)?C(g)△H<0达到平衡后,使用催化剂,只能加快反应速率,不会引起平衡的移动;升高温度,加快反应速率,反应逆向移动;降低压强,反应逆向移动,速率减慢;增加A的量,平衡正向移动,反应速率加快;减少C的量,正向移动,速率减慢,化学平衡向哪个方向移动,则那个方向的速率快于另一个方向的速率,据此回答.
解答 解:(1)反应A(g)+B(g)?C(g)△H<0达到平衡后,使用催化剂,只能加快反应速率,不会引起平衡的移动,故选D;
故答案为:D;不移动;
(2)升高温度,加快反应速率,反应逆向移动,故选B;故答案为:B;逆反应;
(3)降低压强,反应逆向移动,速率减慢,故选C;故答案为:C;逆反应;
(4)增加A的量,平衡正向移动,反应速率加快,故选A;故答案为:A;正反应;
(5)减少C的量,正向移动,速率减慢,故选E,故答案为:E;正反应.
点评 本题考查化学平衡的影响因素及化学平衡图象,明确不同因素对化学平衡的影响及由图象得出一个量变化引起另一个量的变化是解答本题的关键.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
 常温下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
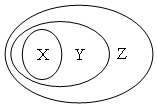 用下图表示的一些物质或概念间的从属关系中不正确的是( )
用下图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 氯化钠 | 电解质 | 化合物 |
| C | 金属氧化物 | 碱性氧化物 | 氧化物 |
| D | 牛奶 | 胶体 | 分散系 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微量元素缺少或者摄入过多,都可能导致患各种代谢疾病 | |
| B. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 | |
| C. | 人体缺钙,可以多喝硬水补钙 | |
| D. | 缺铁性贫血,可通过食用铁强化酱油预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | B. | c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(HS-)+c(S2-)+c( H2S) | D. | c(HS-)+c(S2-)+c(H2S)=1.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,Kw减小 | |
| B. | 在ZnSO4溶液中各离子的浓度关系为:2c(Zn2+)+c(H+)═c(OH-)+2c(SO42-) | |
| C. | 在0.5 L 0.10 mol•L-1的ZnSO4溶液中加入等体积的0.02 mol•L-1的AgNO3溶液,即可生成Ag2SO4沉淀 | |
| D. | 常温下,要除去0.20 mol•L-1 ZnSO4溶液中的Zn2+,至少要调节pH≥8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com