
【题目】下列有关物质用途的说法正确的是
A. 氧化钠可用作潜艇供氧剂
B. 单晶硅用于制备光导纤维
C. 食盐可通过侯氏制碱法制备纯碱
D. 氯化亚铁用于蚀刻工业铜电路板
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
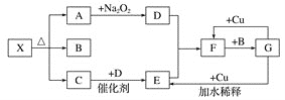
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中放出的热量为______kJ。
(2)肼(N2H4)-空气燃料电池(产物为N2和H2O)是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:_______,负极的电极反应式:_______。
(3)如图是一个电解过程示意图。
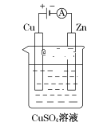
①锌片上发生的电极反应式是:____________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气______L.(假设空气中氧气体积分数为20%;Cu相对原子质量:64)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.X是一种集洗涤、漂白、杀菌于一体的新型漂白剂(由四种短周期元素组成的纯净物),无毒无味,性能温和,且对环境友好。X从组成形式上可看成是某种正盐M与活性物质N的加合产物(mM·nN ,类似于结晶水合物,相对分子量不超过400)。现将X按如下流程实验,气体A能使带火星的木条复燃,固体B溶于水所得溶液显碱性,且焰色反应呈黄色。

请回答:
(1) X中含有的非金属元素是________,写出X灼烧的化学方程式是_________________。
(2)向X的溶液中通入少量SO2,请写出离子方程式__________________。
II .某化学兴趣小组为了探究硫酸铁溶液与铜粉反应的限度问题,向一定量的硫酸铁溶液中加入过量的铜粉,充分振荡后溶液逐渐变蓝,过滤,向滤液中滴加2滴0.2mol/L KSCN溶液。实验现象为:溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。甲同学猜想出现异常现象是由于溶液中的Cu2+干扰了Fe3+的检验,查阅相关资料如下:
①CuSCN是一种白色沉淀物
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
(1)该兴趣小组所记录的实验现象说明铜与铁离子的反应__________(填有或没有)限度。
(2)请用离子方程式分别解释“溶液变为红色”、“振荡后红色迅速褪去并有白色沉淀生成”现象的原因:___________________________________、_________________________________。
(3)为了进一步探究,该小组向盛有2mL 0.5mol/L FeSO4和0.2mol/L KSCN混合溶液的试管中,滴加5滴0.05mol/L硫酸铜溶液,有白色沉淀生成,且溶液变红。请解释溶液变红的可能原因(可以不止一种):
①____________,②___________,③_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下3.6gH2O含有的电子数为2NA
B.2.8g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C.0.lmolCl2与足量的铁粉充分反应转移的电子数为0.2NA
D.1L0.2mol/l的K2SO3溶液中SO![]() 的数目为0.2NA
的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.少量二氧化硫通入氯化钡溶液中,产生白色沉淀亚硫酸钡 | B.在新制Cu(OH)2悬浊液中加入少量的葡萄糖,加热,产生砖红色沉淀 | C.将少量钠投入到无水乙醇中,钠表面有气泡产生 | D.在盛水的烧杯中加入氯化钠固体,小灯泡会逐渐亮起来 |
A. AB. BC. C...D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A. ![]() 时加入了催化剂B.
时加入了催化剂B. ![]() 时降低了温度
时降低了温度
C. ![]() 时增大了压强D.
时增大了压强D. ![]() 时间内转化率最高
时间内转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酰氯(SOC12)又名氯化亚砜,其熔点一105℃,沸点79℃,140℃以上时易分解。是一种无色或淡黄色发烟液体,遇水剧烈与水反应生成SO2和另一酸性气体,常用作脱水剂,广泛应用于医药、农药、来料工业及有机合成工业。
(1)氯化亚砜储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是___;用硫黄、液氯和三氧化硫为原料在一定条件可合成氯化亚砜,如果想达到原子利用率最大化,则三者的物质的量之比为___。
(2)实验室合成SOCl2的原理之一为SO2+Cl2+SCl2![]() 2SOCl2,部分装置如图所示。
2SOCl2,部分装置如图所示。
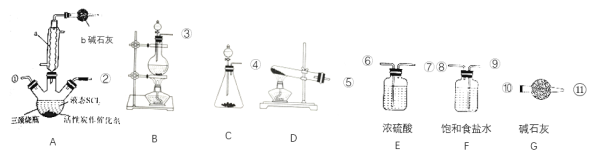
①装置b的作用是___。
②实验室制取SOCl2所选仪器的链接顺序:③→___。
(3)甲同学设计如图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。选用装置如图: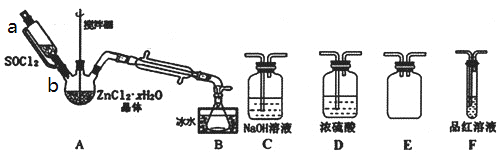
①向仪器A中缓慢滴加SOCl2,需打开活塞___(填“a”、“b”或“a和b”)。
②为了更加充分的回收SOCl2,写出可对装置B采取的有效措施___。
(4)乙同学认为利用(3)中装置,由FeCl3·6H2O制取无水FeCl3也可用SOCl2作脱水剂,但丙同学认为会发生氧化还原反应而难以制无水FeCl3。丙同学设计了如下实验方案验证自己的观点:
取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,加入___,证明该过程发生了氧化还原反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com