
| A. | 在自然界里存在氢气 | B. | 燃烧氢气污染小 | ||
| C. | 氢气轻,便于携带 | D. | 氢气燃烧发热量高 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键 | C-C | C-H | O=O | H-O | C-O | C=O |
| 键能/(kJ•mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
| 实验编号 | 实验步骤 | 实验现象 |
| 1 | 向4mL无水乙醇中加入1mL溴水,充分振荡,静置4小时 | 溶液橙黄色褪去,溶液接近无色 |
| 2 | 向4mL无水乙醇中加入1mL溴水,加热至沸腾 | 开始现象不明显,沸腾后溶液迅速褪色 |
| 向淀粉KI溶液中滴加冷却后的上述混合液 | 溶液颜色不变 | |
| 3 | 向4mL水中加入1mL溴水,加热至沸腾 | 橙黄色略变浅 |
| 向淀粉KI溶液中滴加冷却后的溴水混合液 | 溶液变蓝 |
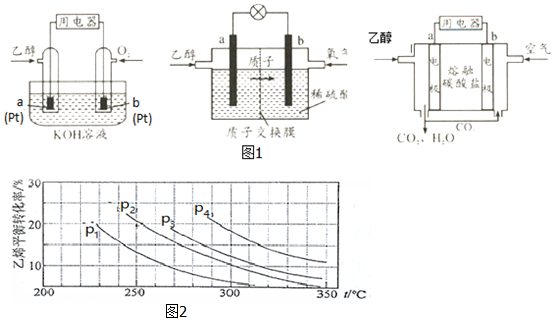
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别取两种固体样品,加热产生气体的是碳酸氢钠 | |
| B. | 分别取样溶于水后加入氯化钙溶液,若有白色沉淀则是碳酸钠 | |
| C. | 分别取样溶于水后加入澄清石灰水,若有白色沉淀则是碳酸钠 | |
| D. | 分别取等质量的两种固体样品,与足量的硫酸反应,产生气体较多的是碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可加入酸性KMnO4溶液鉴别苯、乙醇和四氯化碳 | |
| B. | 碳酸钠溶液、蛋白质溶液均具有丁达尔效应 | |
| C. | 煤的干馏、石油的分馏、油脂的水解都是化学变化 | |
| D. | 蔗糖与稀硫酸溶液共热后加入银氨溶液,再水浴加热产生银镜,证明蔗糖水解产物中有葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④① | C. | ③②④① | D. | ①④②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H++OH-═H2O CH3COOH+NaOH═CH3COONa+H2O | |
| B. | Ba2++SO42-═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | CO32-+2H+═CO2↑+H2O CaCO3+2HCl═CaCl2+CO2↑+H2O | |
| D. | Al(OH)3+OH-═AlO2-+2H2O Al(OH)3+NaOH═NaAlO2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com