
| A. | 浓硝酸见光或受热易分解,必须保存在棕色瓶中 | |
| B. | 浓HNO3是种强氧化剂,但只能使湿润蓝色的石蕊试纸显红色而不褪色 | |
| C. | 稀HNO3和活泼金属反应时主要得到氢气 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
分析 浓硝酸具有不稳定性,见光易分解,浓硝酸具有强的氧化性和酸性,能够使指示剂先变色后褪色,稀硝酸具有强的氧化性,与金属反应不会生成氢气,浓硝酸具有强的氧化性,常温下能够使铁钝化,据此解答.
解答 解:A.浓硝酸见光易分解,须存放在棕色细口瓶中,故A正确;
B.浓HNO3是种强氧化剂,但只能使湿润蓝色的石蕊试纸显红色而后褪色,故B错误;
C.稀硝酸具有强的氧化性,与金属反应不会生成氢气,故C错误;
D.浓硝酸具有强的氧化性,常温下能够使铁钝化,阻止反应进行,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉浓硝酸的不稳定性、强氧化性、酸性是解题关键,注意钝化属于化学变化,题目不难.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是用于衡量化学反应进行快慢的物理量 | |
| B. | 决定化学反应速率的主要因素是反应物本身的性质 | |
| C. | 可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零 | |
| D. | 增大反应物浓度或升高反应温度都能加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
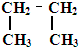
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 用乙醇和3%的硫酸共热到170℃制取乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
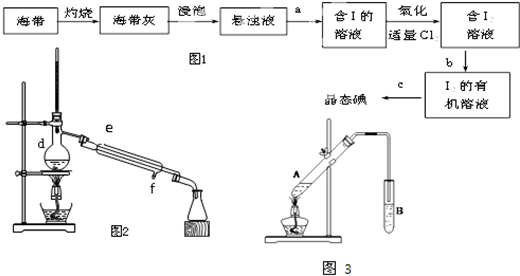
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
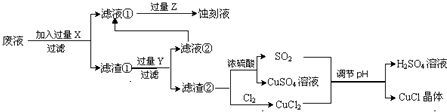
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com