
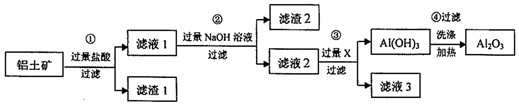
分析 步骤①Al2O3、Fe2O3与稀盐酸反应生成盐和水,反应方程式为Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,SiO2和稀盐酸不反应,然后采用过滤方法得到滤渣1为SiO2、滤液1中溶质有AlCl3、FeCl3,向滤液1中加入过量NaOH溶液,发生的反应为Al3++4OH-=AlO2-+2H2O、Fe3++3OH-=Fe(OH)3↓,过滤得到的滤渣2为Fe(OH)3,滤液2中含有NaAlO2、NaOH,向滤液乙中通入过量二氧化碳,发生的离子反应方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,过滤后得到滤渣氢氧化铝,滤液3为碳酸氢钠,加热氢氧化铝得到氧化铝固体,反应方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,据此分析解答.
解答 解:(1)步骤①为Al2O3、Fe2O3与稀盐酸反应生成盐和水,反应方程式为Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,SiO2和稀盐酸不反应,然后采用过滤方法得到滤渣1为SiO2;
故答案为:Fe2O3+6H+=2Fe3++3H2O、Al2O3+6H+=2Al3++3H2O;SiO2;
(2)步骤②为向滤液1(滤液1中溶质有AlCl3、FeCl3)中加入过量NaOH溶液,其中氯化铝生成偏铝酸钠,反应物额:AlCl3+4NaOH=3NaCl+Na[Al(OH)]4或AlC13+4NaOH=3NaCl+NaAlO2+2H2O;铝离子与氨水反应生成氢氧化铝沉淀,铁离子也沉淀,无法将铁离子、铝离子分离,故不能用氨水替代氢氧化钠;
故答案为:AlCl3+4NaOH=3NaCl+Na[Al(OH)]4或AlC13+4NaOH=3NaCl+NaAlO2+2H2O;不能;若用氨水,Fe3+与Al3+均沉淀,无法将二者分离;
(3)步骤③为向偏铝酸钠中加入过量的X最终得到氢氧化铝沉淀,应为二氧化碳,反应为:CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;
故答案为:CO2;CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;
(4)得到A12O3的质量为nkg,则其中铝元素的质量为$\frac{27}{51}×n$ kg,根据铝元素质量守恒,则原铝土矿中的铝元素质量也为$\frac{27}{51}×n$ kg,故铝土矿中铝元素的质量分数为:$\frac{27n}{51m}×100%$;
故答案为:$\frac{27n}{51m}×100%$.
点评 本题考查物质分离和提纯,为高频考点,涉及物质之间反应、基本实验操作,明确物质性质差异性及物质分离提纯方法是解本题关键,知道每个步骤发生的反应及操作方法,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
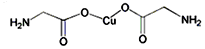
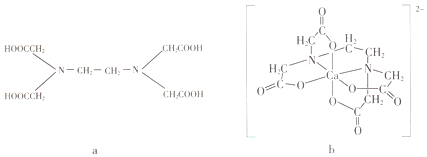 a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )
a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )| A. | b含有分子内氢键 | B. | b中Ca2+的配位数为4 | ||
| C. | b含有共价键、离子键和配位键 | D. | a和b中的N原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
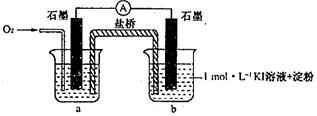
| 序号 | 烧杯中的液体 | 5分钟后现象 |
| ① | 2mL 1mol•L-1KI溶液+5滴淀粉 | 无明显变化 |
| ② | 2mL1mol•L-1KI 溶液+5 滴淀粉+2mL0.2mol•L-1HC1 | 溶液变蓝 |
| ③ | 2mLl mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1KC1 | 无明显变化 |
| ④ | 2mL1mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1CH3COOH | 溶液变蓝,颜色 较②浅 |
| 序号 | 烧杯中的液体 | 5小时后现象 |
| ⑤ | 2mL混有KOH的pH=8.5的lmol•L-1KI溶液+5滴淀粉 | 溶液略变蓝 |
| ⑥ | 2mL混有KOH的pH=10的lmol•L-1KI溶液+5滴淀粉 | 无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在普通钢中加入镍、铬等多种元素可炼成不锈钢 | |
| B. | 硬铝、青铜、金箔都属于合金,合金的性能一般优于纯金属 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着致密的氧化膜,对内部金属起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
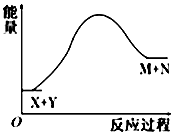
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X和Y的总能量一定低于M和N的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
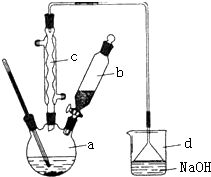 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 ,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池是常见的二次电池,性能优良,比能量高,缺点是废弃电池铅污染严重 | |
| B. | 用玻璃棒蘸取KMnO4(H+)溶液,滴在pH试纸上,然后与标准比色卡对照,测定其pH | |
| C. | 石油的分馏、蛋白质的盐析、焰色反应、煤的液化与气化都是物理变化 | |
| D. | 在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com