
【题目】海水开发利用的部分过程如图所示。下列有关说法不正确的是 )
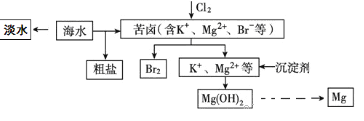
A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
B. 空气吹出法是工业规模海水提溴的常用方法。其工艺的其中一个环节是把氯气通入酸化的浓缩海水(或苦卤)中。
C. 在工业上一般选用氢氧化钠溶液作为图示中的沉淀剂。
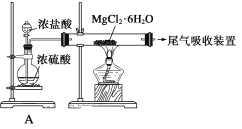
D. 由Mg(OH)2可以制得MgCl2·6H2O,某兴趣小组同学设计了如下装置制取无水MgCl2。其中装置A的作用是制取干燥的HCl气体。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg 和 Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol1) | 786 | 715 | 3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是______,Na核外有__________种不同的能级。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可用右图简单表示,其中配位键和氢键均采用虚线表示。

①SO42 中S的杂化类型是____________,与其互为等电子体的离子有___________(任写两种)
②已知 [Cu(NH3)4]2+ 具有对称的空间构型,[Cu(NH3)4]2+ 中的两个NH3被 Cl 取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_______________。
③写出基态Cu2+ 的价层电子排布式:_________;金属铜采取_________堆积方式,已知Cu原子的半径为 r pm,NA 表示阿伏加德罗常数的值,金属铜的密度是_______________g/cm3(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0
①该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为____________mol。
③该反应中,还原剂为_____________(填化学式),氧化产物与还原产物的质量比为______________。
(2)也可以利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_________________________________。
(3)还可利用ClO2消除氮氧化物的污染,反应过程如下(部分反应物或生成物略去):
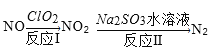
反应I的产物中还有两种强酸生成,且其中一种强酸为硝酸,且硝酸与NO2物质的量相等,则化学反应方程式为______,反应中若生成22.4L N2(标准状况),则消耗ClO2______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是
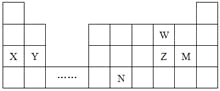
A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将氨气通入水中,发生化学反应的方程式有_______;下列有关分析中正确的是_______;
A.常温时氨气易溶于水
B.通常情况下氨气在水中的溶解度不大
C.溶于水的氨气分子有少量发生电离
D.氨水中的NH3H2O可电离出少量OH-
E.氨本身具有弱碱性
F.在饱和氨水中含量最多的溶质是NH3H2O
(2)氨水有许多用途,请任写一个用氨水制取不溶性碱的方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1的溶液中,可以大量共存的离子组是( )
A. K+、Na+、SO42-、S2- B. NH4+、Mg2+、SO42-、Cl-
C. Na+、K+、HCO3-、Cl- D. K+、Na+、AlO2-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的树状分类和交叉分类,HNO3属于( ) ①酸②氢化物③氧化物④含氧酸⑤难挥发性酸⑥一元酸⑦化合物⑧混合物.
A.①②③④⑤⑥⑦
B.①④⑥⑦
C.①⑧
D.①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp[Fe(OH)3]=2.6×10-39,回答下列问题:
(1)FeCl3溶液可用做净水剂,其净水原理为(用离子方程式表示):______________________。
(2)某酸性MgCl2溶液中含有少量FeCl3,为得到纯净的MgCl2溶液,可加入___________调节溶液的pH=4,使溶液中的Fe3+变为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________________。
(3)由FeCl3·6H2O晶体得到纯的无水FeCl3的合理方法是:______________________________。
(4)草酸亚铁是制备高纯度活性铁粉的原料,其样品纯度测定步骤如下:准确称取草酸亚铁(FeC2O4)样品wg,将其研成粉末后溶于适量的稀硫酸中(假设杂质不反应)配成250omL溶液。准确量取20mL该溶液于锥形瓶中,用cmol/L的K2Cr2O7酸性溶液(用稀硫酸酸化)滴定至终点,消耗滴定液VmL(还原产物为Cr3+,氧化产物为Fe3+和CO2)。
①滴定时反应的离子方程式为____________________________________。
②该草酸亚铁样品的纯度为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com