
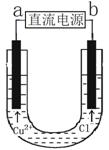
用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是
A.通电使CuC12发生电离
B.a端是直流电源的负极
C.阳极上发生的反应:Cu2++2e- == Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
【知识点】电解原理 F4
【答案解析】B 解析: A、电离过程是电解质在水分子作用下发生的离解过程,不是通电条件,通电使电解质发生氧化还原反应,故A错误;B、依据图中离子移动方向分析,电解过程中阳离子移向阴极,阴离子移向阳极分析确定电极名称,氯离子移向阳极,则b电极为电源正极,a为电源负极,故B正确;C、依据离子移动方向可知阳极是氯离子失电子发生氧化反应,电极反应为2Cl--2e-=Cl2↑,故C错误;D、氯离子在阳极失电子生成氯气,通电一段时间后,在阳极附近观察到黄绿色气体,故D错误。
【思路点拨】本题考查了电解原理的分析应用,电极分析判断,电极反应分析,离子移动方向的判断,掌握基础是关键,题目难度中等。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
已知环戊烯结构简式为: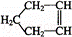 可简写为:
可简写为:
降冰片烯的分子结构可表示为: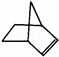
(1)降冰片烯属于
A.环烃 B.不饱和烃 C.烷烃 D.芳香烃
(2)降冰片烯的分子式为 ;
(3)降冰片烯不具有的性质
A.能溶于水 B.发生氧化反应 C.加成反应 D.常温常压下为气体
(4)写出环戊烯在一定条件下加聚反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
在2升的密闭容器中,发生以下反应:2A(g)+B(g)⇌2C(g)+D(g).若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12mol/(L•s),则10秒钟时,容器中B的物质的量是( )
|
| A. | 1.6 mol | B. | 2.8 mol | C. | 2.4 mol | D. | 1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请回答下列问题:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .直到因加入一滴盐酸后,溶液由黄色变为橙色,并 为止.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是 (填字母)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面分别如图所示,则起始读数为 mL,终点读数为 26.10 mL;所用盐酸的体积为 mL.
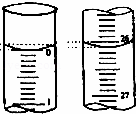
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)如图所示:
(1)若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀。
请写出正极反应式 。
(2)若开始时开关K与b连接时,两极均有气体产生,
则N端是电源的 极(填正或负)则总反应的离子方程式为 。
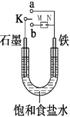 |
(Ⅱ)用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
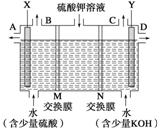
(1)X极与电源的_____(填“正”或“负”)极相连,氢气从_____(填“A、B、C或D”)口导出。
(2)已知离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”)交换膜。
(3)若制得标准状况下5.6 L氧气,则生成氢氧化钾的质量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A—I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中σ与π键数目比为 B、C、D第一电离能由小到大的顺序为 (填写元素符号)
 (2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 。
(2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 。
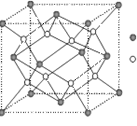
(3)D与G可以形成右图的晶胞,则黑点表示的是 元素(填写元素符号),该元素原子在该晶胞中的配位数为
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的元素更改为另外两种元素,则这个晶胞化学式为 ,若再将留下的所有原子换成另外一种新元素的原子,则成为另外一种晶胞,该晶胞中成键原子键角为 。
(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为 如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为 。(阿伏加德罗常数用NA表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
从Cu、O2、NaOH、盐酸、CaCO3、NaNO3、CaO、AgNO3八种物质中选出合适的,按要求各写出一个方程式.
(1)化合反应 (化学方程式)
(2)分解反应 (化学方程式)
(3)置换反应 (离子方程式)
(4)有气体放出的复分解反应 (离子方程式)
(5)有沉淀生成的复分解反应 (离子方程式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com