
有关物质间有下图所示的转化关系。其中:A的浓溶液与单质B在加热时才发生反应①;A的稀溶液与足量B发生反应②。据此填写下列空白:
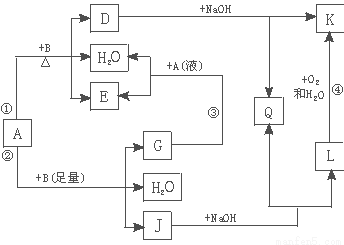
(1)反应④的现象是 。
(2)写出反应②的离子方程式 。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答):
(1)白色沉淀→灰绿色→红褐色沉淀
(2)3Fe+2NO3-+8H+=3 Fe 2++2NO↑+4 H2O
(3)由反应2HNO3+NO=3NO2+H2O知,在浓硝酸中不可能生成NO
【解析】
试题分析:(1)A的浓溶液与单质B在加热时才发生反应①,A的稀溶液与足量B不加热可发生反应②,且②有3种产物,猜测A是硝酸,不是硫酸;硝酸具有强氧化性,与浓硝酸需加热才进行的B应是与浓硝酸发生钝化的金属铁或铝;由反应④可知B是变价金属铁;则J是硝酸亚铁,与氢氧化钠反应生成氢氧化亚铁和硝酸钠;所以反应④是氢氧化亚铁与氧气、水反应生成氢氧化铁的反应,现象是白色沉淀迅速转化为灰绿色,最终成为红褐色;
(2)反应②是稀硝酸与过量Fe反应生成硝酸亚铁、水、NO,离子方程式为3Fe+2NO3-+8H+=3 Fe 2++2NO↑+4 H2O;
(3)由流程图可知G是NO,与硝酸反应又生成NO2和水,所以浓硝酸与铁加热反应时,若生成NO立即又转化为NO2,所以实质是不可能生成NO。
考点:考查物质推断,离子方程式的书写,对题目信息的理解应用


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
古代器物上的颜料至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确的是
A.用盐的形式表示: BaSiO3·CuSiO3 B.用氧化物形式表示:BaO·CuO·2SiO2
C.易溶于强酸、强碱 D.性质稳定,不易褪色
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:选择题
下列实验操作中错误的是( )
A.过滤操作时如果有必要可以用蒸馏水洗涤滤纸上的沉淀2-3次
B.蒸馏操作时,应使温度计水银球插入液态混合物中
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:选择题
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
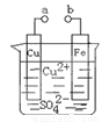
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:选择题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备——2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备——2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是( )
A.高铁酸钾与水反应时,水发生氧化反应
B.干法中每生成1mol Na2FeO4共转移4mol电子
C.湿法中每生成1mol Na2FeO4共转移3mol电子
D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二5月月考化学试卷(解析版) 题型:填空题
环境问题正成为21世纪世界的热点问题,请填写下列空白。
①在二氧化碳、二氧化硫、二氧化氮、氟氯烃中,能造成臭氧层空洞的物质有_______和二氧化氮;能造成酸雨的主要因素是__ __和二氧化硫含量的增加。
②高铁酸钾(K2FeO4)是新型、高效的水处理剂,其氧化性比氯气、臭氧等更强,遇水易变化,在水处理过程中高铁酸钾被还原为Fe3+。高铁酸钾除能消毒、杀菌外,还能除去水中的悬浮颗粒的原因是___ _____(用化学方程式表示)。
③废水中的Cr3+、Ag+、Hg2+等常采用 法消除污染
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二5月月考化学试卷(解析版) 题型:选择题
给汽车安装尾气净化装置,汽车尾气通过净化装置(内有钯等过渡金属元素做催化剂)后,其中的有害气体CO、NO转化为无害气体N2、CO2则( )
| A. | NO作为还原剂 | B. | CO作为还原剂 | C. | N2作为还原剂 | D. | CO2作为氧化剂 |
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高一下学期期末考试化学试卷(解析版) 题型:填空题
A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题
(1)E、G两种元素的符号:E、G;F在元素周期表中的位置是 .
(2)Zn与稀硫酸反应需加入少量硫酸铜溶液反应速率会大大加快,其原理是 。
(3) E在D2中燃烧生成化合物X中阴阳离子个数比为 ;X中的阴离子电子式为 .
(4)能够说明可逆反应2CD2(g)  C2D4(g)达到平衡状态的标志是 ;
C2D4(g)达到平衡状态的标志是 ;
①单位时间消耗2mol CD2的同时,生成1 mol C2D4 ②恒温恒压下,混合气体的密度不变③CD2和C2D4的浓度之比为2∶1 ④混合气体的颜色不变⑤单位时间消耗4mol CD2的同时,消耗2mol C2D4
(5)向含E的最高价氧化物的水化物0.5 mol的水溶液中通入标况下BD2气体11.2L,其化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省下学期期中考试高二化学试卷(解析版) 题型:推断题
甲、乙、丙三位同学,分别在相同条件下用乙酸与乙醇反应来制取乙酸乙酯,但未用饱和Na2CO3溶液来吸收。
(1)甲、乙、丙同学将得到的酯提纯,在未用指示剂的情况下,他们都先加NaOH中和
过量的酸,然后用蒸馏法将酯分离出来。但得到的结果却不同:①甲得到了不溶于水
的中性酯;②乙得到显酸性的酯;③丙得到大量水溶性物质。试分析产生上述各种现
象的原因。
(2)丁同学为了进一步找出原因,将所得产物进行了分离探究,他的实验操作步骤流程
如下图。请你帮他完成该实验并填写下列空白。
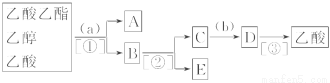
分离出的物质名称:A ,B ,
C ,D ,E ;
选择的试剂:a ,b ;
分离物质的方法:① ,② ,③ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com