
分析 (1)用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2,由反应物、生成物及电子、原子守恒书写离子方程式,亚铁离子具有还原性,可以利用氧化剂和压离子反应的现象检验亚铁离子的存在;
(2)工业上是利用氯气和石灰乳反应生成氯化钙、次氯酸钙和水,氯化氢极易溶于水,氯气在饱和食盐水中溶解性减小;
(3)铝分别和足量的氢氧化钠和稀硫酸反应,如果生成相同条件下等量的氢气,依据电子守恒计算分析;
(4)先根据化合物与氯离子间的关系计算氯化物的物质的量,根据M=$\frac{m}{n}$计算其摩尔质量,摩尔质量在数值上等于其相对分子质量,从而确定该金属的原子量;
(5)根据n=$\frac{V}{{V}_{m}}$计算混合气体的总的物质的量,设CO的物质的量为x mol,CO2的物质的量为y mol,根据质量之和与物质的量之和列式计算CO和CO2的物质的量,进而计算二者物质的量之比.
解答 解:(1)用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2,由反应物、生成物及电子、原子守恒可知反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,亚铁离子具有还原性,检验Fe3+溶液中混有Fe2+的试剂是酸性KMnO4溶液,滴入高锰酸钾溶液紫红色褪去,证明含亚铁离子,
故答案为:2Fe3++Cu=2Fe2++Cu2+,酸性KMnO4溶液;
(2)工业上是利用氯气和石灰乳反应生成氯化钙、次氯酸钙和水,氯化氢极易溶于水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H2O,因氯气与水发生:Cl2+H2O?H++Cl-+HClO,氯气难溶于饱和食盐水,但HCl极易溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体,
故答案为:2Cl2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H2O,饱和食盐水;
(3)铝分别和足量的氢氧化钠和稀硫酸反应,如果生成相同条件下等量的氢气,这两个反应中都是铝失电子,由转移电子守恒知,需要铝的物质的量之比为1:1,
故答案为:1:1;
(4)某二价金属的氯化物中氯化物的物质的量与氯离子的物质的量之比为1:2,氯离子的物质的量为0.20mol,所以氯化物的物质的量是0.10mol,M=$\frac{m}{n}$=$\frac{9.5g}{0.10mol}$=95g•mol-1;摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为95,其相对分子质量=其相对原子质量+35.5×2=95,所以该金属元素的相对原子质量为24.
故答案为:95g•mol-1;24;
(5)标准状况下,混合气体的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,
设CO的物质的量为x mol,CO2的物质的量为y mol,则:
x+y=0.3
28x+44y=12
解得:x=0.075mol,y=0.225mol,
此混合物中CO和CO2物质的量之比=0.075mol:0.225mol=1:3,
故答案为:1:3.
点评 本题考查了离子方程式的书写、离子性质和检验、混合物计算、物质的量有关计算等知识点,注意对公式的理解与灵活应用,明确氧化还原反应电子守恒和结合转移电子守恒进行计算是解本题关键,题目难度中等.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
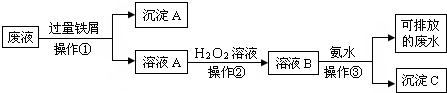
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物都是金属氧化物 | |
| B. | 酸性氧化物都是非金属氧化物 | |
| C. | NaO2能与酸反应生成盐和水,所以 NaO2是碱性氧化物 | |
| D. | SiO2 既能和氢氧化钠溶液反应又能和氢氟酸反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA个水分子所占的体积约为22.4L | |
| B. | 5.6g铁与氯气完全反应,失去电子的数目为0.2NA | |
| C. | 1mol C12发生化学反应,转移的电子数一定为2NA | |
| D. | 在标准状况下,22.4L由N2、N2O组成的混合气体中所含有的氮原子为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别放在炒锅中加热,观察是否有残留物 | |
| B. | 分别用干净铁丝蘸取样品在燃气炉的火焰上灼烧,观察火焰颜色 | |
| C. | 在水杯中各盛少许相同质量的样品,分别加入足量的水,观察样品是否溶解 | |
| D. | 在水杯中各盛少许相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁片粉与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氧化亚铁粉末溶于盐酸中:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 铜与氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 向硫酸铝溶液中加入过量氨水:Al3++4OH-═AlO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 小苏打用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 计算机芯片所用的材料是高纯度的硅 | |
| D. | 纯净的二氧化硅是生产光纤制品的基本原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com