
| A. | 氢键比范德华力强,所以它属于化学键 | |
| B. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 含氢原子的物质之间均可形成氢键 | |
| D. | 分子间形成的氢键使物质的熔点和沸点升高 |
分析 A.氢键存在于分子间,化学键存在于分子内;
B.氢键只影响物质的物理性质,与化合物的稳定性无关;
C.电负性大的元素的氢化物中易形成氢键;
D.氢键的存在使分子间作用力增强,能够显著提高物质的熔沸点.
解答 解:A.氢键存在于分子间,化学键存在于分子内,所以氢键不是化学键,故A错误;
B.氢键只影响物质的物理性质,H2O是一种非常稳定的化合物,是因为H-O键的稳定性强,故B错误;
C.电负性大的元素的氢化物中易形成氢键,电负性较小元素的氢化物不能形成氢键,如甲烷分子间不能形成氢键,故C错误;
D.氢键的存在使分子间作用力增强,能够显著提高物质的熔沸点,故D正确.
故选:D.
点评 本题考查了氢键的存在和对物质性质的影响,题目难度不大,把握氢键的概念是解题的关键,注意氢键只影响物质的物理性质,与物质的稳定性无关.


科目:高中化学 来源: 题型:选择题
| A. | Na+ Ag+ CO32- Cl- | B. | K+ Ba2+SO42- Cl- | ||
| C. | Na+ K+ CO32- Cl- | D. | Na+ K+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
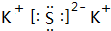 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
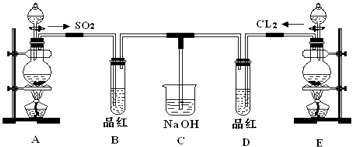
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氢氧化钙的溶解是吸热过程 | |
| B. | 温度升高时氢氧化钙溶解的速度减慢 | |
| C. | t℃时氢氧化钙的 Ksp约等于2.46×10-6 | |
| D. | 向只含有Ca(OH)2 和Mg(OH)2]两种沉淀的悬浊液中滴加NaOH浓溶液,分散系中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$比值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与氧化铁高温下发生反应 | D. | 将锌粒投入FeCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质编号 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① | 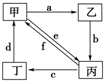 | Cu | CuO | CuCl2 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | Al(OH)3 | Al2O3 | Na[Al(OH)4] | AlCl3 |
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com