
【题目】硒(Se)是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1) Se元素基态原子的电子排布式为____;第四周期中第一电离能比Se元素大的共有____种(氪元素除外)。
(2)气态SeO3分子的价层电子对互斥模型为____ ;SeO42-离子中Se原子的杂化方式为 ___ 。
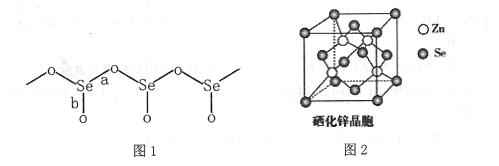
(3)固态SeO2是以[SeO3]角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如下图1所示)。
①图1中Se-O键键长较短的是 ___(填“a"或“b"),其原因是______。
②SeO2熔点为350℃,固态SeO2属于___晶体,其熔点远高于SO2(-75.5℃)的原因是 ____。
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)= ____nm(计算结果保留3位有效数字,下同);硒化锌晶体的密度为________ g.cm-3。
【答案】1s22s22p63s23p63d104s24p4或[Ar]3d104s24p4 2 平面三角形 sp3杂化 b b中含有π键,电子云重叠程度更大,使得键长缩短 分子 SeO2形成聚合分子,相对分子量远比SO2大,熔化时需要破坏分子间作用力更大 0.198 5.45
【解析】
(1)Se与O元素同主族,位于第四周期,其元素序号为34,Se元素基态原子的电子排布式为1s22s22p63s23p63d104s4p4或[Ar]3d104s24p4;同一周期中,第一电离能从左至右有增大的趋势,但IIA族与IIIA族、VA族与VIA族反常,第四周期中第一电离能比Se元素大的有As、Br两种元素(氪除外);
(2)SeO3分子中σ键电子对数为3,孤电子对数为![]() ,故分子构型为平面三角形;
,故分子构型为平面三角形;![]() 中σ键电子对数为4,孤电子对数为
中σ键电子对数为4,孤电子对数为![]() ,价层电子对数为4,因此Se原子采取sp3杂化;
,价层电子对数为4,因此Se原子采取sp3杂化;
(3)①根据结构图示以及O原子成键特点可知,a为单键,b为双键,因此键长较短的是b;其原因是:b中含有π键,电子云重叠程度更大,使得键长缩短;
②固态SeO3的熔点不是特别高,由此可知,固态SeO3为分子晶体;由题可知,SeO2形成聚合分子,相对分子量远比SO2大,熔化时需要破坏分子间作用力更大,因此熔点较SO2高;
(4)Se2-采取面心立方最密堆积方式,设r(Se2-)=rnm,则![]() ,解得r≈0.198;一个晶胞中含有Se2-个数为
,解得r≈0.198;一个晶胞中含有Se2-个数为![]() ,含有Zn2+个数为4,硒化锌晶体的密度
,含有Zn2+个数为4,硒化锌晶体的密度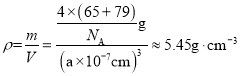 。
。


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1 mol/LNaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数 如图所示:
如图所示:
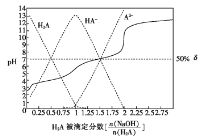
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1NaA溶液中: ![]()
C.0.1 mol·L-1NaHA溶液中: ![]()
D.H2A 的K2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属混合物共15g,投入足量的盐酸中,充分反应后得到11.2LH2(标准状况),则原混合物的组成肯定不可能为( )
A. Mg和AlB. Zn和MgC. Al和ZnD. Al和Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,化学式可表示为[Fea(OH)b(SO4)c]m,取其与足量盐酸反应,所得溶液平均分为两份,一份溶液加入足量的BaCl2溶液,得到沉淀4.66 g。另一份溶液,加入足量的NaOH溶液后过滤,对滤出固体洗涤,后灼烧得到红棕色固体质量为1.6 g,该聚合硫酸铁样品中a∶b的比值是
A. 1∶1B. 2∶1C. 3∶1D. 2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
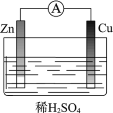
【题目】某原电池装置如图所示。其中,Zn电极为原电池的______极(填“正”或“负”),电极反应式是______________。Cu电极上发生的反应属于______(填“氧化”或“还原”) 反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应不属于取代反应的是
A. C2H5OH + CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
B. H﹣C≡C﹣H + HCl![]() H2C=CHCl
H2C=CHCl
C. ![]() + HNO3
+ HNO3![]()
![]() +H2O
+H2O
D. ![]() + Br2
+ Br2![]()
![]() +HBr
+HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A是生石灰的主要成分,B是一种具有漂白性的无色气体,D是一种常见的无色液体,F是某种补血剂的有效成分,G是一种常见的强酸,H的摩尔质量为72 g·mol-1。

(1)A的化学式为____________。
(2)D的电子式为____________。
(3)写出反应①的化学方程式:________________________。
(4)写出反应②的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象及结论均正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 | 黄色溶液中只含Br2 |
B | 烧杯中看见白色沉淀 | 证明酸性强弱:H2CO3>H2SiO3 |
C | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液;未出现银镜 | 蔗糖未水解 |
D | pH试纸先变红后褪色 | 氯水既有酸性,又有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成药物盐酸沙格雷酯的重要中间体,其合成路线如图:
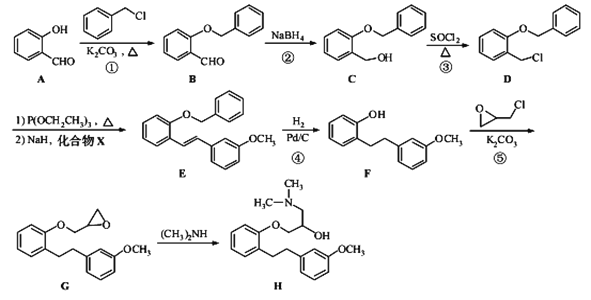
(1)化合物A中的含氧官能团为___和___(填官能团名称)。
(2)反应⑤的反应类型是___,反应方程式___。
(3)B的分子式___,1molB与足量的银氨溶液反应,最多能产生___gAg。
(4)检验D中卤原子种类,所需的试剂有___。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
a.分子中含有两个苯环;
b.分子中有7种不同化学环境的氢;
c.不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com