
2012年8月7日“好奇号”传回火星第一张彩照,火星岩石中富含铁而使其表面呈红色,下列有关铁的说法中正确的是(已知Fe是26号元素)( )
A.铁元素位于周期表中第4周期第ⅦB族
B.57Fe和55Fe互为同素异形体
C.铁比铝更易被腐蚀,说明铁比铝活泼
D.铁原子在化学反应中可失去2个或3个电子
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
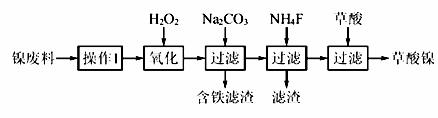
(1)操作1为 。
(2)生产过程中多次进行过滤,实验室进行过滤操作中需用到玻璃棒,下列实验操作中哪些操作中玻璃棒的作用完全相同的是 (填选项字母)。
①配制0.1mol/L的H2SO4溶液
②测定Na2CO3溶液的pH
③用KI淀粉试纸检验溶液中的氧化性离子
④加热食盐溶液制备NaCl晶体
⑤配制20%的KNO3溶液
A.①⑤ B.②③ C.④⑤ D.①④
(3)加入H2O2发生的主要反应的离子方程式为 ;加入Na2CO3溶液调pH至4.0~4.5,其目的为 ; 加入NH4F后除掉的杂质是 。
加入NH4F后除掉的杂质是 。
(4)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为 。
(5)工业上还可用电解法制取Ni2O3。用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后采用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(6)电解法制取Ni2O3的实际过程中,有时获得一种结晶水合物,已知含1molNi的该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,获得Ni2O3固体和0.2mol水,则该结晶水合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
今有A、B两种元素的原子,已知A原子M层有x个电子,N层有y个电子,B原子的M层有(x+5)个电子,N层有(y+5)个电子,则A、B分别是 (填写元素符号)_____________,其电子排布式分别为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,已知某溶液中由水电离生成的H+和OH-的物质的量浓度乘积为1×10-24,则在该溶液中,一定不能大量存在的离子是( )
A.S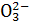 B.N
B.N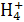 C.N
C.N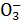 D.HC
D.HC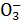
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,将V1mLc1mol·L-1的氨水滴加到V2mLc2mol·L-1的盐酸中,下述结论中正确的是( )
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则混合液中c(N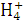 )=c(Cl-)
)=c(Cl-)
C.若混合溶液的pH=7,则混合液中c(N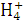 )>c(Cl-)
)>c(Cl-)
D.若V1=V2,且混合溶液的pH<7,则一定有c1<c2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法不正确的是( )
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE所含化学键的类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为一张没有填写内容的元素周期表。
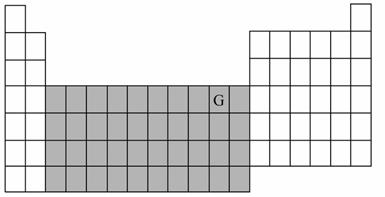
(1) 已知A、B、C、D、E、F六种短周期元素的原子半径和某些化合价如下表所示:
| 元素 | A | B | C | D | E | F |
| 化合价 | -2 | +5、-3 | +4、-4 | +6、-2 | +2 | +1 |
| 原子半径 /nm | 0.074 | 0.075 | 0.077 | 0.102 | 0.160 | 0.186 |
试将B、E两种元素的元素符号填入上图所示周期表中的相应位置。
(2)写出基态G原子的电子排布式:____________________________。
(3) 图中阴影部分所示区域的元素称为___________元素,下列元素属于该区域的是___________。
A.Ba B.Fe C.Br D.Rb
(4)A、B、C三种元素的电离能大小为_________________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(CH3)3NH+和AlCl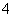 可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作____________(填代号)。
可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作____________(填代号)。
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
查看答案和解析>>
科目:高中化学 来源: 题型:
有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定 B.原子晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂 D.氯化钠熔化时离子键未被破坏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com