
【题目】关于NaHCO3的性质,下列说法正确的是(双选)( )
A.和酸反应放出等量的CO2所消耗的酸比Na2CO3少
B.相同温度下溶解度比Na2CO3要大
C.热稳定性比Na2CO3大
D.NaHCO3只能和酸作用不能和碱作用
科目:高中化学 来源: 题型:
【题目】“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用。它的有效成分是下列物质中的一种,这种物质是( )
A. NaOHB. NaClOC. KMnO4D. Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( ) 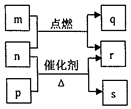
A.原子半径:X<Y<Z
B.非金属性:X>Y>Z
C.W、X、Y、Z四种元素可形成离子化合物
D.q与s均为酸性氧化物,m的水溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中乙醇分子断裂的仅是碳氧键的是( )
A.乙醇与金属钠反应产生氢气
B.乙醇在浓硫酸140℃条件下反应
C.乙醇与氢卤酸发生取代反应生成卤代烃
D.乙醇在酸性重铬酸钾的氧化下生成乙醛或乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃,将2 mol X和1 mol Y充入体积为1L的密闭容器中,已知:2X(g)+Y(g) ![]() 2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
A. 在10 min时,X的反应速率为0.02 mol·L-1·min-l
B. 在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
C. 无法计算该温度下Y的平衡转化率
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨的合成工业的下列说法正确的是( )
A.从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低
B.由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高
C.合成氨工业的反应温度控制在400~500 ℃左右,目的是使平衡向正反应方向进行
D.合成氨工业采用10 MPa~30 MPa,是因该条件下催化剂的活性最好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数K的说法正确的是
A. 已知碳酸: K1=4.4×10-7,K2=4.7×10-11,次氯酸: K1=2.98×10-8,碳酸钠溶液中滴加少量氯水的离子方程式为: CO32-+Cl2+H2O=HCO3-+Cl-+HClO
B. 1.0mol/LNH4HCO3溶液pH=8.0。由此可知Ka1(H2CO3)> Kb(NH3·H2O)>Ka2(H2CO3)
C. 常温下电离常数为Ka 的酸HA溶液中c(H+)= ![]()
D. 将0.1mol/LMgSO4溶液滴入NaOH 溶液中至不再有沉淀产生,再滴加0.1mo/LCuSO4溶液,白色沉淀变为蓝色沉淀,可得出Ksp[Cu(OH)2]sp[Mg(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐并可提取镁和溴等物质.
(1)海水淡化的方法主要有(填一种);
(2)下列物质不需要经过化学变化就能从海水中获得的物质是 (填序号);
A.液溴
B.食盐
C.氢气
D.淡水
(3)从海水中提取溴和镁的流程如下: 
①写出下列步骤的离子方程式或化学方程式
步骤I的化学方程式: ,
步骤III的离子方程式: ,
步骤IV的化学方程式: .
②操作A是 , 操作B是 , 从步骤II得到的溶液中提取溴还需要进行的操作有:、萃取、蒸馏.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com