
【题目】利用硫酸厂烧渣(含铁的氧化物和少量FeS及SiO2)制碱式硫酸铁的流程如下:

(1)SO2与过量NaOH溶液反应的离子方程式为_____________。
(2)滤渣的主要成分为_________(填化学式)。
(3)反应1中加双氧水的目的是将Fe2+氧化为Fe3+,该反应的离子方程式为________。
(4)碱式硫酸铁的化学式为Fex(OH)y(SO4)z·nH2O,为确定其组成进行如下实验:
①称取1.6920g样品溶于足量的稀盐酸中;
②加足量的BaCl2溶液,过滤、洗涤、干燥、称重,得固体质量为2.3300g;
③向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400g。
根据以上实验数据确定该碱式硫酸铁的化学式_________(写出计算过程)。
【答案】 SO2+2OH-=SO32-+H2O SiO2 2Fe2++H2O2+2H+=2Fe3++2H2O Fe(OH)2(SO4)5·6H2O
【解析】(1)当NaOH过量时,与酸性氧化物发生反应产生正盐和水,SO2与过量NaOH溶液反应的离子方程式为SO2+2OH-=SO32-+H2O;(2)硫酸厂烧渣含铁的氧化物和少量FeS及SiO2,当焙烧时,会发生反应产生Fe2O3、SO2,向其中加入稀硫酸,发生反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,原烧渣中的SiO2不能反应,也不能溶解,过滤除去,因此滤渣的主要成分为SiO2;(3)在烧渣焙烧的过程中可能有部分FeS未完全煅烧,在酸溶时变为Fe2+留在溶液中,加入H2O2可以将溶液中的Fe2+氧化为Fe3+,得到的滤液中只含有阳离子Fe3+,反应的方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(4)在1.6920g样品中含有的SO42-的物质的量是:n(SO42-)=2.3300 g÷233g/mol=0.01mol,向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400g。该固体为Fe2O3,n(Fe2O3)=0.6400g÷160g/mol=0.004mol,则n(Fe3+)=2n(Fe2O3)=0.008mol,由于任何化合物阳离子带的正电荷总数与阴离子带的负电荷总数相等。3n(Fe3+)=n(OH-)+2n(SO42-),所以n(OH-)=3n(Fe3+)-2n(SO42-)=3×0.008mol-2×0.01mol=0.004mol,根据质量守恒定律可知含有结晶水的物质的量是![]() ,则该碱式硫酸铁样品中的n(Fe3+):n(OH-):n(SO42-):n(H2O)=0.004mol:0.01mol=4:2:5:6,因此化学式为Fe(OH)2(SO4)5·6H2O。
,则该碱式硫酸铁样品中的n(Fe3+):n(OH-):n(SO42-):n(H2O)=0.004mol:0.01mol=4:2:5:6,因此化学式为Fe(OH)2(SO4)5·6H2O。


科目:高中化学 来源: 题型:
【题目】硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____________。
(2)该反应中发生氧化反应的物质是__________,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(3)48.0 g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 L气体(标准状况下),反应中消耗HNO3的物质的量可能是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质: FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______ ![]() ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并写出配平后的离子方程式:_________________________。
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念——“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是( )
A.Cu ![]() Cu(NO3)2
Cu(NO3)2
B.Cu ![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu ![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2 ![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:
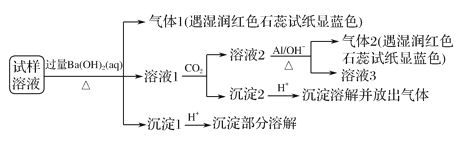
已知:3NO![]() +8Al+5OH-+2H2O
+8Al+5OH-+2H2O![]() 3NH3↑+8AlO
3NH3↑+8AlO![]() ,根据以上的实验操作与现象,该同学得出的结论不正确的是( )
,根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A. 试样中肯定存在NH![]() 、Mg2+、SO
、Mg2+、SO![]() 和NO
和NO![]()
B. 试样中一定不含Al3+
C. 试样中可能存在Na+、Cl-
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有48.4 g碱式碳酸镁样品(化学式:xMgCO3·yMg(OH)2·zH2O,x、y、z为正整数),将其分为二等份,一份样品充分灼烧至恒重进行热重分析,结果如图所示。另一份投入150 mL某浓度的盐酸中,充分反应后生成CO2 4.48 L(已折算成标准状况下),所得溶液稀释至250 mL,测得溶液的c(H+)=0.100 mol·L-1。

按要求回答下列问题:
(1)盐酸的物质的量浓度c(HCl)=________mol·L-1。
(2)x∶y∶z=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁的工业生产流程如下:
![]()
下列说法错误的是
A.此法的优点之一是原料来源丰富
B.该提取镁的过程中涉及置换、分解、复分解和氧化还原反应
C.步骤①②③的目的是从海水中提取无水MgCl2
D.步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)在标准状况下,CO和CO2混合气体的质量为32g,体积为22.4L,则其中CO与CO2物质的量之比为_____________,所含O原子的数目为_____________;将其中的CO2与足量的过氧化钠反应,反应中转移电子的物质的量为_____________。
(2)在实验室将16.8g固体NaHCO3加热一段时间后,测得剩余固体的质量变为13.7g。则减少的为_______物质的质量,有______gNaHCO3发生了分解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中下列电离方程式书写不正确的是( )
A.H2SO4=2H+ + SO42-B.KHCO3=K++ HCO3-
C.NaOH=Na+ + OH-D.NaHSO4=Na++ HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为2SnO2 + 3C![]() 2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
A. 反应中SnO2被还原 B. a的值为3
C. 反应后有两种氧化产物 D. 每生成1 mol CO2转移电子8 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com