
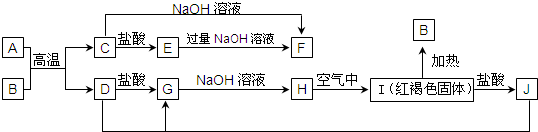
分析 I为红褐色固体,则I为Fe(OH)3,加热分解生成B为Fe2O3,I与盐酸反应生成J,则J为FeCl3.D与J反应生成G,G与氢氧化钠反应生成H,H在空气中转化为氢氧化铁,则H为Fe(OH)2.A、D为金属单质,A与B的反应生成C与D,则C为金属氧化物,C能与氢氧化钠、盐酸反应,则C为Al2O3,故A为Al,D为Fe,则G为FeCl2,结合转化关系可知E为AlCl3,F为NaAlO2,据此解答.
解答 解:I为红褐色固体,则I为Fe(OH)3,加热分解生成B为Fe2O3,I与盐酸反应生成J,则J为FeCl3.D与J反应生成G,G与氢氧化钠反应生成H,H在空气中转化为氢氧化铁,则H为Fe(OH)2.A、D为金属单质,A与B的反应生成C与D,则C为金属氧化物,C能与氢氧化钠、盐酸反应,则C为Al2O3,故A为Al,D为Fe,则G为FeCl2,结合转化关系可知E为AlCl3,F为NaAlO2.
(1)由上述分析可知,B是Fe2O3,H为Fe(OH)2,故答案为:Fe2O3;Fe(OH)2;
(2)J与D反应转化为G的离子方程式为:2Fe3++Fe═3Fe2+,故答案为:2Fe3++Fe═3Fe2+;
(3)A为Al,在常温下也可与NaOH溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)H转化成I是氢氧化亚铁被氧化为氢氧化铁,反应化学反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查无机物推断,难度中等,I为红褐色及C能与酸、碱反应等为突破口,侧重考查学生的推理能力及对与元素化合物的性质熟练掌握,注意基础知识的积累掌握.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
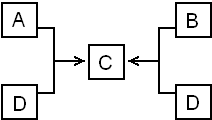 已知A与盐酸反应生成B和氢气.根据右图回答下列问题:
已知A与盐酸反应生成B和氢气.根据右图回答下列问题: ;C的化学式为NaAlO2;B+D→C的离子方程式为Al3++4OH-=2AlO2-+2H2O.
;C的化学式为NaAlO2;B+D→C的离子方程式为Al3++4OH-=2AlO2-+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
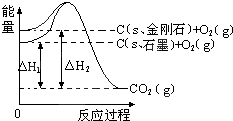
| A. | 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 集气瓶中气体的颜色不变 | B. | 集气瓶中有火星出现 | ||
| C. | 集气瓶内壁上有油状液体出现 | D. | 集气瓶口有棕黄色烟出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请回答:
请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com