
【题目】某核素![]() 的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数为_________。
(2)若X的核内中子数为12,求47.5gXCl2中所含质子的物质的量是________。
【答案】24 23mol
【解析】
(1)利用Cl-+Ag+=AgCl↓来计算Cl-的物质的量,从而得出XCl2的物质的量,再利用M=![]() 计算XCl2的摩尔质量,进而计算X的质量数;
计算XCl2的摩尔质量,进而计算X的质量数;
(2)中子数+质子数=质量数,据此计算X原子质子数,根据n=![]() 计算37gXCl2的物质的量,进而计算所含质子的物质的量。
计算37gXCl2的物质的量,进而计算所含质子的物质的量。
(1)硝酸银的物质的量n(AgNO3)=c·V=1mol/L× 0.02L=0.02mol,根据Cl-+Ag+=AgCl↓可知,则n(Cl-)=n(Ag+)=n(AgNO3)=0.02mol,则n(XCl2)=![]() n(Cl-)=0.01mol,所以XCl2的摩尔质量M(XCl2)=
n(Cl-)=0.01mol,所以XCl2的摩尔质量M(XCl2)=![]() =95g/mol,由于摩尔质量是以g/mol为单位,数值上等于该物质的相对分子质量,所以其相对分子质量为95,则X的相对原子质量为95﹣35.5×2=24,即X的质量数为24;
=95g/mol,由于摩尔质量是以g/mol为单位,数值上等于该物质的相对分子质量,所以其相对分子质量为95,则X的相对原子质量为95﹣35.5×2=24,即X的质量数为24;
(2)根据中子数+质子数=质量数,X的质量数为24,若X的核内中子数为12,则X的质子数为24-12=12,Cl原子的的质子数为17,则47.5gXCl2中所含质子的物质的量n(质子)=![]() ×(12+17×2)=23mol。
×(12+17×2)=23mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
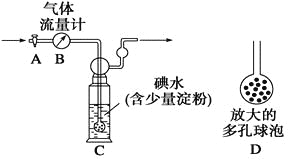
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_______________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示:
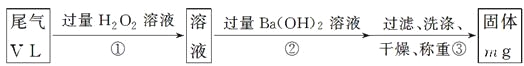
(3)步骤①中过量H2O2的作用是________________________________________
(4)写出步骤②中反应的化学方程式_______________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是________________________________
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为__________________________(用含有V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。请回答下列问题:
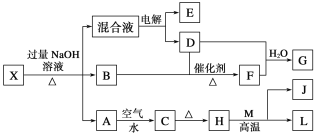
(1)B的电子式为____________。
(2)电解混合液时阳极反应式为_______________________。
(3)写出L长期放置在潮湿空气中的腐蚀原理:
负极:___________________________________。
正极:___________________________________。
总反应:______________________________________________________。
(4)已知a g E气体在D中完全燃烧生成稳定的化合物时,放出b kJ的热量,写出E气体燃烧热的热化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可以用于制取漂白剂和自来水杀菌消毒。常温下,溶液中Cl2(aq)、HClO和ClO-物质的量分数(α)随pH变化的关系如图所示。
已知,Cl2(g)![]() Cl2(aq)K1=10-1.2
Cl2(aq)K1=10-1.2
Cl2(aq)+H2O![]() HClO+H++Cl-K2=10-3.4
HClO+H++Cl-K2=10-3.4
下列说法正确的是
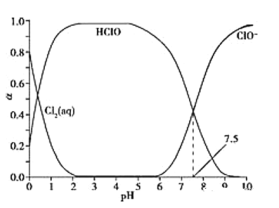
A.Cl2(g)+H2O![]() 2H++ClO-+Cl-K3=10-10.9
2H++ClO-+Cl-K3=10-10.9
B.氯气通入水中,c(HClO)+c(ClO-)<c(H+)-c(OH-)
C.pH=7.0时漂白能力要比pH=6.0时要强
D.氯气处理自来水时,在夏天的杀菌消毒效果要比在冬天好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示配制100mL0.100molL﹣1Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:

(1)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是_____。
①干燥的 ②瓶塞不漏水的 ③用欲配制的溶液润洗过的 ④以上三项均须要求的
(2)若用Na2CO310H2O来配制溶液,需要称量晶体_____克。若所称取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_____。(填“大/小”)
(3)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、_____。
(4)步骤B通常称为转移,步骤A通常称为_____。步骤D称为_____,若没有步骤D,则配制的浓度偏_____。(填“大/小”)。
(5)将上述实验步骤A﹣F按实验过程先后次序排列_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为纪念门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年为“国际化学元素周期表年”(IYPT2019)。元素周期表隐含着许多的信息和规律,以下所涉及的元素均为中学化学常见短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法不正确的是

A.元素周期表有7个周期,16个族,共有118种元素,其大多数是金属元素
B.x和e组成的化合物属于离子化合物,该化合物具有较强的还原性
C.d、f、g、h的离子半径顺序g>h>d>f
D.y、z、h的最简氢化物的沸点h>z>y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法错误的是( )
A.1mol NH3中含有3NA个N﹣H键
B.36g C60含分子数为0.05NA
C.标准状况下,11.2L CO2中含有2NA个共用电子对
D.18g重水(![]() H2O)中含有10NA个电子
H2O)中含有10NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某物理研究所取得重大科技成果,研制出由18O所构成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是( )
A.1.8 g 18O构成的气体的物质的量是0.05 mol
B.0.1 mol重氧水H218O所含的中子数约为6.02×1023
C.0.2 mol 18O2气体的体积约为4.48 L
D.18O2的摩尔质量为36 g·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com