
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
| 平衡时n(SO3)/mol | 1 | m |
| 反应物的转化率 | α1 | α2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、Cl-、NO3- | B. | Ca2+、Al3+、HCO3-、Cl- | ||
| C. | Na+、AlO2-、OH-、SO42- | D. | K+、NH4+、NO3-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提倡人们购物时减少使用塑料袋,是为了减少白色污染 | |
| B. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 硫氧化物和碳氧化物是形成酸雨的主要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | 369 |
| A. | △H=+102kJ/mol | B. | △H=-102kJ/mol | C. | △H=+267kJ/mol | D. | △H=-267kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:| A. | 在T2时,若反应体系处于状态D,则此时v正>v逆 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB | |
| D. | 该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | Z元素氧化物对应水化物的酸性一定强于Y | |
| B. | X、Y、W中最简单氢化物稳定性最强的是X | |
| C. | 四种元素至少有一种为金属元素 | |
| D. | 最简单氢化物的沸点:X<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
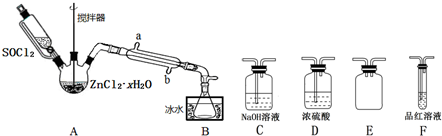
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com