
| A. | 4mol | B. | 8mol | C. | 10mol | D. | 2mol |
科目:高中化学 来源: 题型:选择题
| A. | 要除去含有 A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2 | |
| B. | 还原性强弱顺序为:A2+>B->Z->X2+ | |
| C. | X2+是 XO4- 的还原产物,B2是 B-的氧化产物 | |
| D. | 在溶液中可能发生反应:XO4-+5 A2++8H+=X2++5A3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )| A. | 溶液中OH-、导线中的电子都向电极a移动 | |
| B. | N2在正极生成 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 电极b的反应式为O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
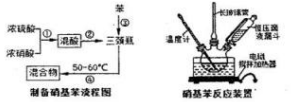
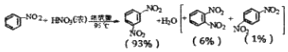
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
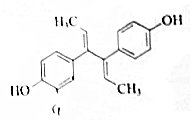 双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )
双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )| A. | 分子式为C18H18O2,可溶于氯仿或氢氧化钠溶液 | |
| B. | 双烯雌酚既可发生加聚反应,也可以发生缩聚反应 | |
| C. | 其苯环上的二氯代物有7种 | |
| D. | 1 mol双烯雌酚跟H2反应,最多可消耗8mol H2. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的链节:-CH2CH(CH3)- | B. | 乙酸的分子式:CH3COOH | ||
| C. | 对硝基苯酚的结构简式: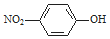 | D. | H2S的电子式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com