
| A. | 某温度时,化学反应速率无论用A、B、C何种物质表示,其数值都是相同的 | |
| B. | 其它条件不变时,升高温度,反应速率加快 | |
| C. | 其它条件不变时,增大压强,反应速率加快 | |
| D. | 若增加或减少A物质的量,反应速率一定会发生明显的变化 |
分析 A、化学反应速率用A、B、C物质表示的数值之比等于系数之比;
B、升高温度,反应速率加快;
C、增大压强只有引起物质的浓度的增加时,才会加快反应速率;
D、固体物质的量增加时,不会加快反应速率.
解答 解:A、化学反应速率用A、B、C物质表示的数值之比等于系数之比,其数值都是不相同的,故A错误;
B、升高温度,任何化学反应速率都会加快,故B正确;
C、增大压强只有引起物质的浓度的增加时,才会加快反应速率,即其它条件不变时,增大压强,反应速率不一定加快,故C错误;
D、固体物质的量增加时,不会加快反应速率,A的状态不确定,所以增加或减少A物质的量,反应速率不一定会发生明显的变化,故D错误.
故选B.
点评 本题考查影响化学反应速率的因素,为高频考点,把握常见的影响反应速率的因素为解答的关键,注重基础知识的考查,注意纯固体、纯液体不影响反应速率,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯气和液氯是两种不同的物质 | |
| B. | Cl2通入到含有酚酞的NaOH溶液中红色褪去,因为氯气有漂白性 | |
| C. | Cl2在化学反应中既能作氧化剂,又能作还原剂 | |
| D. | 新制的氯水呈酸性,向其中滴加几滴紫色石蕊试液并振荡,溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
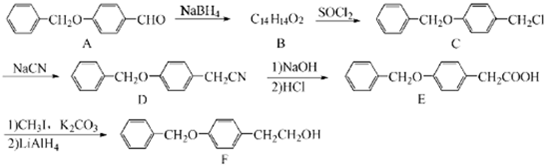
 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应.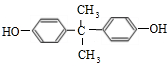
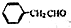 为原料制备
为原料制备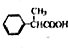 的合成路线示意图(无机试剂任用).合成路线示意图例如题干.
的合成路线示意图(无机试剂任用).合成路线示意图例如题干.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

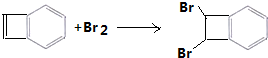
 +2CH3CH2OH$?_{△}^{浓硫酸}$
+2CH3CH2OH$?_{△}^{浓硫酸}$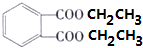 +2H2O
+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
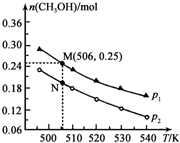 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | a+b>c+d | ||
| C. | C的体积分数降低 | D. | B的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A. | Z金属可作为牺牲阳极保护法的阳极,保护Y金属 | |
| B. | Y金属不能从硫酸溶液中置换出氢气 | |
| C. | 三种金属的活泼性顺序为:Y>X>Z | |
| D. | Z和Y能构成电压最大的原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热胆矾失去结晶水的过程称风化 | |
| B. | 在饱和溶液中,溶质溶解的速率等于结晶速率 | |
| C. | 原电池是把电能转化为化学能的装置 | |
| D. | 电能是二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
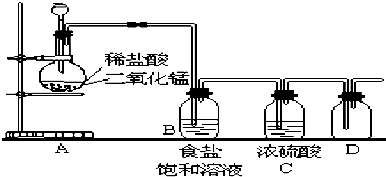
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com