
| A. | 碳酸氢铵溶液与过量的氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+=Al3++3H2O | |
| C. | 二氧化硫和规律氢氧化钠溶液:SO2+OH-=HSO3- | |
| D. | 铜片与稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O |
分析 A.氢氧化钠溶液过量,碳酸氢根离子也参与反应;
B.氢氧化铝与盐酸反应生成氯化铝和水;
C.氢氧化钠溶液过量,反应生成亚硫酸根离子;
D.离子方程式两边总电荷不相等,违反了电荷守恒.
解答 解:A.碳酸氢铵与足量NaOH溶液混合反应生成碳酸钠和一水合氨,反应的离子方程式为:2OH-+NH4++HCO3-=CO32-+NH3•H2O+H2O,故A错误;
B.氢氧化铝与足量盐酸反应生成氯化铝和水,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,故B正确;
C.二氧化硫和过量氢氧化钠溶液反应生成亚硫酸钠和水,正确的离子方程式为:SO2+2OH-=H2O+SO32-,故C错误;
D.铜片与稀硝酸反应生成硝酸铜、NO气体和水,正确的离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2H2O+2OH-═2AlO2-+3H2↑ | |
| B. | Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷 | B. | 异丁烷 | C. | 丁烷 | D. | 丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 |
| A. | 元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 | |
| B. | 元素②氢化物的沸点小于元素⑤氢化物的沸点 | |
| C. | 元素②⑥形成的化合物具有两性 | |
| D. | ⑦①可形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
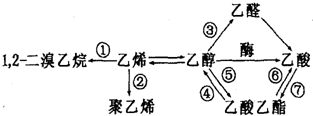
| A. | 反应①需要的条件是光照 | B. | 反应②的反应类型是加聚反应 | ||
| C. | 反应⑤⑦需要稀硫酸做催化剂 | D. | 反应③④⑤⑥⑦都属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
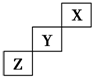
| A. | X、Y、Z三种元素中,X的非金属性最强 | |
| B. | Y的氢化物的稳定性比Z的弱 | |
| C. | Y的最高正化合价为+7 | |
| D. | X的单质不易发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)>c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液的物质的量浓度:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa两溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1 mol•L-1的NaHA溶液,测得pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com