
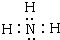 ,A+为NH4+,电子式为
,A+为NH4+,电子式为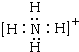 ,
,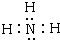 ;
; .
.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E五种物质都含1~18号元素中的某 一 元素,它们按图所示关系相互转化,已知A为单质.
A、B、C、D、E五种物质都含1~18号元素中的某 一 元素,它们按图所示关系相互转化,已知A为单质.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(F)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com