
【题目】海水化学资源开发利用的部分过程如图所示,下列说法正确的是( )
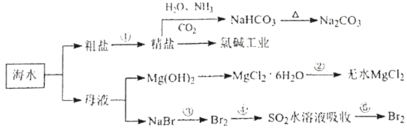
A.用澄清的石灰水可鉴别NaHCO3和Na2CO3
B.从海水中得到粗盐主要是通过蒸发操作实现的
C.在步骤③,中可通入Cl2使溴离子被还原为Br2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH增大
【答案】B
【解析】
海水蒸发溶剂得到粗盐和母液,粗盐通过精制得到精盐,电解饱和食盐水得到氯气、氢气和氢氧化钠,工业上制得饱和食盐水,依次通入氨气、二氧化碳反应生成碳酸氢钠和氯化铵,碳酸氢钠受热分解生成碳酸钠,母液加氢氧化钠反应生成氢氧化镁沉淀,氢氧化镁和酸反应生成氯化镁,制得氯化镁,母液通入氯气氧化溴离子为溴单质,被二氧化硫吸收后发生氧化还原反应生成溴化氢溶液,富集溴元素,通入氯气氧化溴化氢为溴单质得到溴,以此解答该题。
A. 在NaHCO3或Na2CO3中加入澄清的石灰水,现象均为产生白色沉淀,所以不能用澄清的石灰水鉴别NaHCO3和Na2CO3,A错误;
B. 氯化钠的溶解度随温度的变化不明显,故从海水中得到粗盐采用的是蒸发结晶的方法,B正确;
C. 步骤③中发生反应的化学方程式为:2NaBr+Cl2= Br2+2NaCl,Br的化合价由-1价升高为0价,溴离子被氧化为Br2,C错误;
D. 步骤④中SO2水溶液吸收Br2,发生反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,溶液的酸性增强,pH减小,D错误;故答案为:B。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
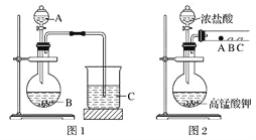
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三个热化学方程式:
(1)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A. -488.3 kJ/mol B. +488.3 kJ/mol
C. -2 228.9 kJ/mol D. +191 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
①3.9g苯与足量的H2反应时,参与反应的碳碳双键数为0.15NA
②3.1g氧化钠和3.9g过氧化钠的混合物中含有的阴离子总数为0.1NA
③1.8g14CH4和水蒸气(H216O)的混合气体中含电子数目为NA
④常温下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含![]() 的数目相同
的数目相同
⑤常温下4.6gNO2和N2O4,混合气体中所含原子总数为0.3NA
⑥1molSiO2晶体中含有极性共价键数目为2NA
⑦将1molCl2通入足量水中,溶液中HClO、Cl、ClO粒子数之和为2NA
⑧高温下,16.8gFe与足量水蒸气完全反应转移电子数为0.8NA
A.①②④⑥B.②③⑤⑧C.②③⑥⑦D.③⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-a kJ/mol,则a__238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:____。
(3)反应mA(g)+nB(g)![]() pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
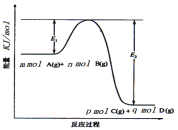
该反应ΔH=___(用含E1、E2式子表示);在反应体系中加入催化剂,E1__,E2__,(填增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+3Y2(g)![]() 2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
①X2为0.2 molL-1 ②Y2为0.1 molL-1 ③Z2为0.3 molL-1 ④Y2为0.6 molL-1
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第26届国际计量大会修订了阿伏加德罗常数的定义,并于2019年5月20日正式生效。NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,11.2 L Cl2含氯原子数为NA
B.0.05 mol![]() 原子中含中子数目为13.3NA
原子中含中子数目为13.3NA
C.l mol FeI2与少量氯气反应时转移的电子数为 2NA
D.常温下,28 g乙烯中含有的碳原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式____________________,已知1mol液态水气化时需要吸收44kJ的热量,则反应![]() 的ΔH为____________________。
的ΔH为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com