
 [化学一选修/有机化学基础]
[化学一选修/有机化学基础]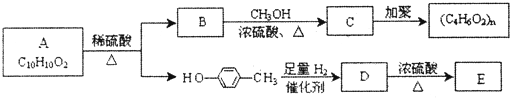
 与足量的氢气发生加成反应生成D为
与足量的氢气发生加成反应生成D为 ,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为
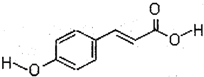
,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为 .芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与
.芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与 ,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为
,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为 ,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为
,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为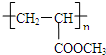 ,据此解答.
,据此解答. 与足量的氢气发生加成反应生成D为
与足量的氢气发生加成反应生成D为 ,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为
,D在浓硫酸、加热条件下生成E,且E能使Br2/CCl4溶液褪色,故发生消去反应,E为 .芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与
.芳香族化合物A(C10H10O2)在浓硫酸、加热条件下生成B与 ,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为
,故A含有酯基,B含有羧基,与甲醇反应生成C,C能发生加聚反应生成高聚物,结合A的分子式可知,B中还含有1个碳碳双键,可推知A为 ,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为
,B为CH2=CH-COOH,C为CH2=CH-COOCH3,高聚物(C4H6O2)n为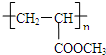 ,
, ,E为
,E为 ,故答案为:
,故答案为: ;
; ;
;| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
| A、Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、向澄清石灰水中通入少量CO2:OH-+CO2=HCO3- |
| D、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>④>③>⑤ |
| B、③>①>④>②>⑤ |
| C、⑤>③>②>①>④ |
| D、③>④>⑤>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
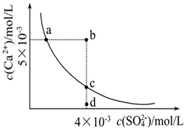 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说| A、常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/LNa2SO4溶液后,溶液中无沉淀析出 |
| B、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L |
| C、d点溶液通过蒸发可以变到c点 |
| D、a点对应的Ksp等于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
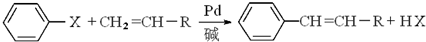 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)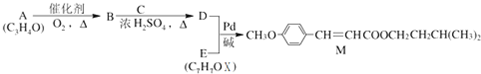
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.1mol/LNaOH溶液 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol/L氨水 | 0.1mol/LMgCl2溶液 | 无现象 |
| Ⅲ | 1mol/L氨水 | 1mol/LMgCl2溶液 | 现象Ⅲ |
| Ⅳ | 1mol/L氨水 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol/L氨水 | 1mol/LMgCl2溶液 | 无现象 |
| A、实验Ⅱ、Ⅴ无现象,而Ⅳ生成白色沉淀,说明增大c(Mg2+)不能向生成沉淀的方向移动,增大氨水溶液的浓度才能向生成沉淀的方向移动 |
| B、实验Ⅲ无现象,因为氯化镁溶液和氨水浓度都增大,则导致氯化铵浓度增大,而氢氧化镁可以溶解在氯化铵溶液中 |
| C、由于氢氧化镁可以溶解在氯化铵溶液中,而氯化镁溶液和氨水反应可以生成氯化铵,所以该两种溶液混合后可能会出现先生成沉淀后溶解的现象 |
| D、实验Ⅲ的现象是生成白色沉淀,因为增大两种溶液中任意一种的浓度,都能使混合液的离子积达到氢氧化镁的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
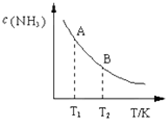 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:| 一定条件 |
| 时间/min 浓度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
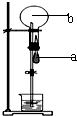 a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )
a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )| A、a-NaOH溶液、b-HCl气体 |
| B、a-NaOH溶液、b-CO2气体 |
| C、a-HCl溶液、b-NH3气体 |
| D、a-水、b-CO2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com