
| A������Һ������0.1mol/L��CH3COOH��Һ��0.1mol/L��NaOH��Һ�������϶��� |
| B������Һ������pH=3��CH3COOH��Һ��pH=11��NaOH��Һ�������϶��� |
| C������Һ������Ũ�ȵĹ�ϵ����c��CH3COO-��+c��OH-����c��Na+��+c��H+�� |
| D����������Һ�м�������NaOH������Ũ�ȴ�С�ɸı�Ϊ��c��CH3COO-����c��Na+����c��OH-����c��H+�� |


 ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��T��ʱ�����ijNaNO2��Һ��pH=8������Һ��c��Na+��-c��NO2-��=9.9��10-7mol?L-1 | ||||||||
| B����֪25��ʱ���й�������ʵĵ���ƽ�ⳣ����HCN��Ka=4.9��10-10��H2CO3��Ka1=4.3��10-8��Ka2=5.6��10-11����CO2ͨ��NaCN��Һ�з�Ӧ�Ļ�ѧ����ʽΪ��2NaCN+H2O+CO2=2HCN+Na2CO3 | ||||||||
C��һ���¶��£�����pH�Ʋⶨ��ͬŨ�ȴ�����Һ��pHֵ���õ��������ݣ�
| ||||||||
| D����֪I3-?I2+I-����ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4�����Ϻ�ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.10mol/L��CH3COOH��Һ�м�ˮϡ�ͣ���Һ��c��OH-����С |
| B��CH3COOH��Һ�м�������CH3COONa���壬ƽ�������ƶ� |
| C��������Һ������Ũ�ȵĹ�ϵ���㣺c��H+��=c��OH-��+c��CH3COO-�� |
| D��������pH=2��CH3COOH��Һ��pH=12��NaOH��Һ�������Ϻ���Һ��pH��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����������Һ�еμ�������������Һǡ�ó����ԣ�C��Na+����C��SO42-����C��NH4+����C��OH-��=C��H+�� |
| B��0.1mol?L-1pHΪ4��NaHB��Һ�У�C��HB-����C��H2B����C��B2-�� |
| C��10mL 0.5mol?L-1 CH3COONa��Һ��6mL 1mol?L-1�����ϣ�C��Cl-����C��Na+����C��CH3COO-����C��H+����C��OH-�� |
| D��pH����Ҵ�����ͬ�¶��µģ�NH4��2SO4��Һ����NH4��2Fe��SO4��2��Һ��NH4Cl��ҺC[��NH4��2SO4]��C[��NH4��2Fe��SO4��2]��C��NH4Cl�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
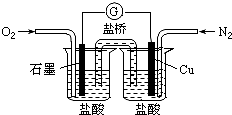 ������ijУʵ��С����Ƶ�һ��ԭ���װ�ã������й���������ȷ���ǣ�������
������ijУʵ��С����Ƶ�һ��ԭ���װ�ã������й���������ȷ���ǣ�������| A����װ���ܽ���ѧ��ת��Ϊ���� |
| B��ʯī�缫�ķ�Ӧʽ��O2+2H2O+4e-=4OH- |
| C��������Cu�缫����������ʯī�缫 |
| D������ܵķ�Ӧ�ǣ�2Cu+O2+4HCl=2CuCl2+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��HCO3-+H2O?CO32-+H3O+ |
| B��HCO3-+H2O?H2CO3+OH- |
| C��HCO3-+OH-?CO32-+H2O |
| D��CO32-+H+=HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ˮ | B��������þ |
| C��̼���� | D��̼��þ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
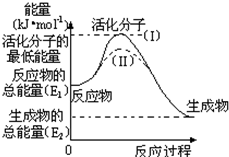 �ڻ�ѧ��Ӧ�У���������ѧ��Ӧ�ķ��Ӽ���ײ��֮Ϊ��Ч��ײ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ����������л�ܣ��䵥λ��kJ?mol-1��ʾ��������۲�ͼ��Ȼ��ش����⣮
�ڻ�ѧ��Ӧ�У���������ѧ��Ӧ�ķ��Ӽ���ײ��֮Ϊ��Ч��ײ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ����������л�ܣ��䵥λ��kJ?mol-1��ʾ��������۲�ͼ��Ȼ��ش����⣮| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com