
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )
选项 | A | B | C | D |
被提纯的物质 | 水(煤油) | 氯乙烷(水) | 甲苯(水) | 乙醇(乙酸) |
除杂试剂 | — | NaOH溶液 | — | NaOH溶液 |
分离方法 | 分液 | 蒸馏 | 过滤 | 分液 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】乙烯直接水合法制乙醇因污染小而应用于工业合成,下列有关说法错误的是( )
A. 该反应属于加成反应
B. 乙烯能使酸性KMnO4溶液褪色
C. 乙烷中含有少量乙烯,可用H2除去
D. 等物质的量的乙烯与乙醇充分燃烧,耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰)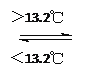 Sn (s、白);DH3=+2.1 kJ/mol
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。
(1)Cl2可与NaOH溶液反应制取消毒液,请写出消毒液中有效成分的电子式__________。
(2)实验室可用MnO2和浓盐酸反应制取Cl2,反应的化学方程式是____________________。
(3)工业上可采取电解饱和食盐水的方法制取Cl2,阳极的电极反应式为________________。
(4)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:4HCl(g) + O2(g)![]() 2Cl2(g) + 2H2O(g) H =-115.4 kJmol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
2Cl2(g) + 2H2O(g) H =-115.4 kJmol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
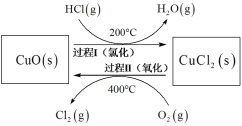
过程I的反应为:2HCl(g) + CuO (s) ![]() CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1
CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1
①过程II反应的热化学方程式为_______。
②过程I流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氯化结束时溶液的现象为_______。
③相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为_______。
④实验测得在不同压强下,总反应的HCl平衡转化率(ɑHCl)随温度变化的曲线如图:
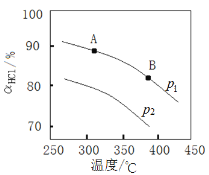
ⅰ.平衡常数比较:K(A)_____K(B) (填“>”“<”或“=”,下同)。
ⅱ.压强比较:p1_____ p2。
(5)以上三种制取Cl2的原理,其共同之处是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。
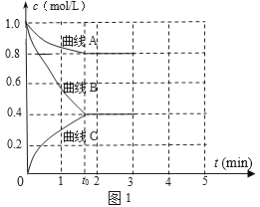
①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
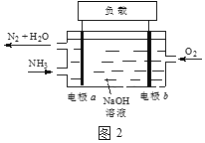
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组欲探究己烷的性质,用己烷进行下利实验:
实验1:![]()
实验2:将上述橙色溶液装入密封性好的无色试剂瓶中。过一段时间,溶液颜色变浅,打开瓶盖瓶口出现白雾。
实验3:根据下图的实验装置进行己烷催化裂化。
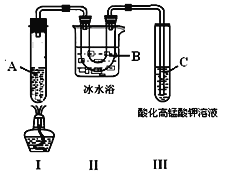
请回答下列问题:
(1)由实验1 知己烷的物理性质有______________;
(2)实验2 中的橙色溶液逐渐变浅的原因是_______;
A.己烷与溴发生发生取代反应 B.溴代己烷为无色物质
C.液溴向外挥发浓度降低 D.己烷与液溴发生加成反应
E.液溴与己烷分层,密度大的液溴在下层
(3)试管C中看到的现象是____________________________,说明有_________生成;
(4)试写出装置Ⅰ中发生有丙烷生成的裂化反应方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ钠是一种活泼金属,能与很多物质反应,
(1)写出金属钠与水反应的化学方程式,并用双线桥标出电子转移的方向和数目__________________________________
(2)该反应的还原剂是_______,(填化学式,下同)
(3)该反应中被还原的元素是___________. (填元素符号),氧化产物是__________.
(4)若反应转移了0.4 mol电子,则产生的气体在标准状况下体积为____________L.
Ⅱ某研究小组同学为了探究硝酸的性质,进行了如下操作:
(1)从试剂柜里取一瓶浓硝酸,发现其保存在________色的试剂瓶里,原因是(用化学方程式表示)_________________________。打开瓶盖,小心地扇闻浓硝酸的气味。
(2)该研究小组欲用该浓硝酸(15 mol/L)来配制480mL 3 mol/L的稀硝酸,则需要量取的浓硝酸的体积是_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是
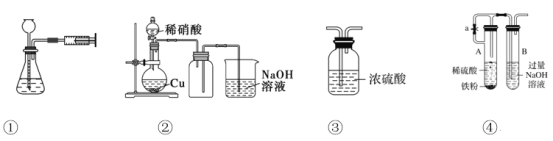
A. 用①所示的操作可检查装置的气密性
B. 用②所示的装置制取少量的NO
C. 用③所示的装置干燥H2、NH3、CO2等
D. 用④所示装置制取Fe(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com