
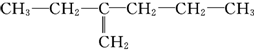 ,乙为
,乙为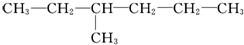 .下列有关它们命名的说法正确的是( )
.下列有关它们命名的说法正确的是( )| A. | 甲、乙的主链碳原子数都是6个 | B. | 甲、乙的主链碳原子数都是5个 | ||
| C. | 甲的名称为2-丙基-1-丁烯 | D. | 乙的名称为3-甲基己烷 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.甲应含双键的最长碳链为主链,最长为5个碳,故A错误;
B.乙最长碳链为6个碳,故B错误;
C.甲的名称为2-乙基-1-丁烯,故C错误;
D.乙的名称为3-甲基己烷,符合命名规则,故D正确.
故选D.
点评 本题考查了有机物的命名,题目难度中等,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 体积之比为2:1 | B. | 原子总数之比为1:2 | ||
| C. | 物质的量之比为1:1 | D. | 氧原子的个数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H>0△S>0 | |
| B. | 铅蓄电池放电时的负极和充电时的正极均发生氧化反应 | |
| C. | 氯化镁溶液加热蒸干得不到纯净氯化镁固体 | |
| D. | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 | |
| B. | 在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| C. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| D. | 常温若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
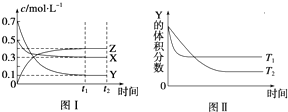
| A. | 该反应的热化学方程式为X(g)+3Y(g)?2Z(g)△H<0 | |
| B. | 若其它条件不变,升高温度,正、逆反应速度均增大,X的转化率增大 | |
| C. | 达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 | |
| D. | 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净化水 | B. | 用氢氧化铝治疗胃酸过多 | ||
| C. | 用铝制容器存放浓硫酸 | D. | 电解熔融氧化铝制单质铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com