
【题目】(1)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890.3kJ/mol
C(石墨)+O2(g)=CO2(g) ΔH2=―393.5kJ/mol
H2(g)+1/2O2(g)=H2O(l) ΔH3=―285.8kJ/mol,
则由石墨生成甲烷的反应热:C(石墨)+2H2(g)=CH4(g) ΔH 4= _________________。
(2)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m________n(填>、<、= )
(3)常温下,某一元酸HA的Ka=2×10-6,则0.5 mol/L该酸溶液的PH =______。
(4)取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的pH等于12,则原溶液的浓度为_________________
【答案】-74.8kJ/mol < 3 0.05mol/L
【解析】
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol,②C(石墨,s)+O2(g)=CO2(g);△H2=-393.5kJ/mol,③H2(g)+1/2O2(g)=H2O(l);△H3=-285.8kJ/moL,反应C(石墨,s)+2H2(g)=CH4(g)可以是②+2×③-①得到,所以焓变△H=(-393.5kJ/mol)+2×(-285.8kJ/moL)-(-890.3kJ/mol)=-74.8kJ/mol,即C(石墨,s)+2H2(g)=CH4(g)△H4=-74.8kJ/mol,故答案为:-74.8kJ/mol;
(2)体积相同,pH均等于1的盐酸和CH3COOH溶液,加水稀释时,促进醋酸的电离,氢离子物质的量增多,盐酸中氢离子物质的量不变,分别加水稀释m倍、n倍,溶液的pH都变成3,氢离子浓度相等,醋酸稀释倍数大,故答案为:m<n;
(3)某一元酸HA的电离方程式为HA![]() A—+H+,设c(H+)=c(Ac-)=amol/L,则电离平衡常数为a2/0.5 mol/L=2×10-6,所以a=10-3mol/L,所以PH=-lgc(H+)=-lg10-3=3,故答案为:3;
A—+H+,设c(H+)=c(Ac-)=amol/L,则电离平衡常数为a2/0.5 mol/L=2×10-6,所以a=10-3mol/L,所以PH=-lgc(H+)=-lg10-3=3,故答案为:3;
(4)设NaOH和HCl的物质的量浓度均为x,NaOH和HCl溶液以3:2体积比相混合,体积分别为3V、2V,酸碱混合后pH=12,则碱过量,剩余的氢氧根离子浓度为:c(OH-)=0.01mol/L,则c(OH-)=(3xV—2xV)/5V =0.01mol/L,解得:x=0.05mol/L,故答案为:0.05mol/L。


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】(1)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_____________________。
(2)工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为2:1。
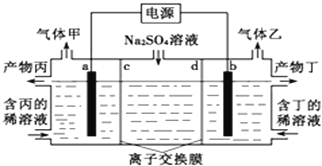
①气体甲的化学式____________ 。
②a极与电源的____________ (填“正极”或“负极”)相连,该电极反应式为_______________。
③离子交换膜d为________(填“阴离子”或“阳离子”)交换膜。
④产物丙为_________ 溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 向明矾溶液中加入足量的烧碱溶液: Al3+ + 3OH-= Al(OH)3↓
B. 在含有等物质的量的Fe(NO3) 2和KI组成的混合溶液中滴入稀盐酸:3Fe2+ + 4H+ + NO3-=3Fe3+ + NO↑ + 2H2O
C. 碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+ OH-= CO32- + H2O
D. 纯碱溶液呈碱性的原因:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g) △H<0。一段时间后均达到平衡状态。下列说法中正确的是
N2O4(g) △H<0。一段时间后均达到平衡状态。下列说法中正确的是
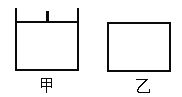
A. 平衡时NO2体积分数:甲<乙
B. 达到平衡所需时间,甲与乙相等
C. 该反应的平衡常数表达式K=c(N2O4)/c(NO2)
D. 若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列数量的各物质所含原子数按由大到小的顺序排列是________。
①0.5 mol氨气
②标准状况下22.4 L氦气
③4 ℃时9 mL水
④0.2 mol磷酸钠(Na3PO4)
(2)现有m g某气体,它是三原子分子,其摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为________mol。
②该气体所含原子总数为________个。
③该气体在标准状况下的体积为________L。
④该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。
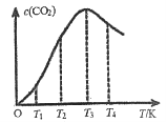
①下列能说明该反应达到平衡的是___________。
A.CO和CO2的浓度之比为1∶1
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T℃时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛.以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:(已知Ksp=3.810﹣38; Ksp=210﹣20;Ksp(ZnS)=1.610﹣24)
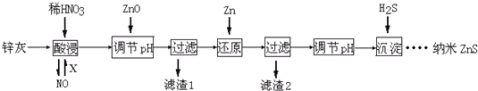
下列说法不正确的是:
A. 酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++ NO3﹣═3Fe3++NO↑+5H2O
B. 将酸浸的尾气循环利用,加入的X气体可以是O2
C. 滤渣2中的成分是Zn和Fe
D. 当溶液中Zn2+浓度为小于1.010﹣5molL﹣1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2﹣浓度应大于1.610﹣19molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com