
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��H2(g)+![]() O2(g)�TH2O(l) ��H=��285.8kJmol��1
O2(g)�TH2O(l) ��H=��285.8kJmol��1
��H2(g)+![]() O2(g)�TH2O(g) ��H=��241.8kJmol��1
O2(g)�TH2O(g) ��H=��241.8kJmol��1
��C(s)+![]() O2(g)�TCO(g) ��H=��110.5kJmol��1
O2(g)�TCO(g) ��H=��110.5kJmol��1
��CO2(g)�TC(s)+O2(g) ��H=+393.5kJmol��1
�ش����и����⣺
��1��������Ӧ�����ڷ��ȷ�Ӧ����___��
��2��H2��ȼ����Ϊ___��C��ȼ����Ϊ___��
��3��ȼ��10gH2����Һ̬ˮ���ų�������Ϊ___��
��4��COȼ�յ��Ȼ�ѧ����ʽΪ___��
���𰸡��٢ڢ� 285.8kJmol��1 393.5kJmol��1 1429kJ CO��g��+![]() O2��g���TCO2��g��
O2��g���TCO2��g�� ![]() H=��283kJmol��1
H=��283kJmol��1
��������
��1���Ȼ�ѧ����ʽ����HΪ��ֵ�ķ�ӦΪ���ȷ�Ӧ����HΪ��ֵ��Ϊ���ȷ�Ӧ��
��2������ȼ���ȵĶ�����⣻
��3�������Ȼ�ѧ����ʽ�з�Ӧ��������ʵ�����֮��Ĺ�ϵ���㡣
��3��������֪���Ȼ�ѧ����ʽ��ϸ�˹���ɼ��㡣
��1���Ȼ�ѧ����ʽ����HΪ��ֵ�ķ�ӦΪ���ȷ�Ӧ����HΪ��ֵ��Ϊ���ȷ�Ӧ������Կ������Ϸ�Ӧ�٢ڢ۾�Ϊ���ȷ�Ӧ�����������ȷ�Ӧ���ʴ�Ϊ���٢ڢۣ�
��2���ɢ��Ȼ�ѧ����ʽ��֪����ȫȼ��1mol��������Һ��ˮ�ų�������Ϊ��285.8kJ����������ȼ����Ϊ��285.8kJmol��1�����ݷ�Ӧ�ܿ�֪����ȫȼ��1molC����CO2���ų�����������393.5kJ����C��ȼ����Ϊ393.5kJmol��1���ʴ�Ϊ��285.8kJmol��1��393.5kJmol��1��
��3���ɢ��Ȼ�ѧ����ʽ��֪����ȫȼ��1mol��������Һ��ˮ�ų�������Ϊ��285.8kJ��ȼ��10gH2����Һ̬ˮ���ų�������Ϊ![]() =1429 kJ���ʴ�Ϊ��1429 kJ��
=1429 kJ���ʴ�Ϊ��1429 kJ��
��4����֪��C��s��+![]() O2(g)�TCO(g)��H=��110.5kJmol��1
O2(g)�TCO(g)��H=��110.5kJmol��1
��CO2(g)�TC��s��+O2(g)��H=+393.5kJmol��1��
�ѷ���ʽ-(��+��)�ã�CO(g)+![]() O2(g)�TCO2(g)��H= -��+393.5kJmol��1��110.5kJmol��1��=��283 kJmol��1���ʴ�Ϊ��CO(g)+
O2(g)�TCO2(g)��H= -��+393.5kJmol��1��110.5kJmol��1��=��283 kJmol��1���ʴ�Ϊ��CO(g)+![]() O2(g)�TCO2(g) ��H=��283 kJmol��1��
O2(g)�TCO2(g) ��H=��283 kJmol��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ������SiO2 ��̼��Ӧ����ȡ�裬д����Ӧ�Ļ�ѧ����ʽ___________________��
��ҵ�ϻ���������þ��ȡ�裬��ӦΪ2Mg+SiO2 = 2MgO+Si��ͬʱ�ᷢ������Ӧ��2Mg + Si = Mg2Si����ͼ�ǽ���Mg��SiO2��Ӧ��ʵ��װ�ã��Իش��������⣺
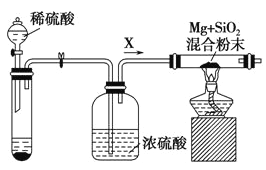
��1������O2��H2O��g���Ĵ��ڶԸ�ʵ���нϴ�Ӱ�죬ʵ����Ӧͨ������X��Ϊ���������Թ��еĹ���ҩƷ��ѡ��________(�����)��
a��ʯ��ʯ������b��п��������c������
��2��ʵ�鿪ʼʱ��������ͨһ��ʱ��X���壬�ټ��ȷ�Ӧ��������� ___________________________������Ӧ���������߾ƾ��ƣ���Ӧ�ܼ������У���ԭ����______________________��
��3����Ӧ��������ȴ������ʱ������Ӧ��Ļ�����м���ϡ���ᣬ�ɹ۲쵽�����Ļ��ǣ������������ԭ���Ǹ�����Mg2Si������Ѹ�ٷ�Ӧ����SiH4�����飩���壬Ȼ��SiH4��ȼ���û�ѧ����ʽ��ʾ��������Ӧ��________________________��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O��CO�ǻ�����Ⱦ�����壬����Pt2O+ ����ת��Ϊ�����壬�䷴Ӧԭ��ΪN2O(g) + CO(g)![]() CO2(g) + N2(g) ��H���йػ�ѧ��Ӧ�����ʱ仯���̼������仯�������¡�����˵������ȷ����
CO2(g) + N2(g) ��H���йػ�ѧ��Ӧ�����ʱ仯���̼������仯�������¡�����˵������ȷ����
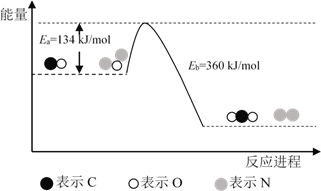
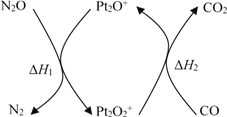
A. ��H = ��H1 + ��H2
B. ��H = 226 kJ/mol
C. �÷�Ӧ����Ӧ�Ļ��С���淴Ӧ�Ļ��
D. Ϊ��ʵ��ת���費����Ӧ���в��� Pt2O+ �� Pt2O2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʿռ�վ����CO2��һ����Ҫ�����ǽ�CO2��ԭ�����漰�ķ�Ӧ����ʽΪ��CO2(g) + 4H2(g)![]() CH4(g) + 2H2O(g)�����¶ȴ�300������400������Ӧ���´ﵽƽ��ʱ��H2������������������й��ڸù��̵��ж���ȷ����
CH4(g) + 2H2O(g)�����¶ȴ�300������400������Ӧ���´ﵽƽ��ʱ��H2������������������й��ڸù��̵��ж���ȷ����
A. �÷�Ӧ����H < 0 B. ��ѧƽ�ⳣ��K����
C. CO2��ת�������� D. ����Ӧ���������淴Ӧ���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�����ӷ���ʽ����ȷ����(����)
A.��Ƭ����NaOH��Һ�������������2Al+2OH��+2H2O=2AlO2+3H2��
B.��K2Cr2O7��Һ�еμ�����ŨH2SO4����Һ��ɫ���Cr2O72(��ɫ)+H2O2CrO42(��ɫ)+2H+
C.��Na2SiO3��Һ��ͨ�����CO2�Ʊ�����������SiO32- +CO2+H2O=H2SiO3(����)+ CO32-
D.��Na2CO3��Һ���ݹ�¯ˮ��(��CaSO4)��CaSO4+CO32-![]() CaCO3+SO42-
CaCO3+SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȸʯ����Ҫ�ɷ�ΪCuCO3��Cu(OH)2��ƴӿ�ȸʯ��ұ��ͭ�ķ������£�

��1������ȸʯ�����Ŀ����_______���������ϡ���ᣬ�ɹ۲쵽��������_______
��2������a��������_______������Һ�м���������۷����ķ�Ӧ��___________�������ӷ���ʽ��ʾ��
��3��������Һ�м���A��Ŀ����______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú���ҹ���Ҫ�Ļ�ʯȼ�ϣ�ú������ҵ�в�����H2SҲ��һ����Ҫ�Ĺ�ҵ��Դ��
(1)úҺ����_____(����������������ѧ��)�仯���̡�
(2)úҺ�������в�����H2S���������ᣬ���ֹ�����ͼ��ʾ��

��SO2��Ӧ���еĻ�ѧ����ʽ��_____��
�����������е�β����Ҫ�ⶨSO2�ĺ������ϱ������ŷţ���֪��V L(�ѻ���ɱ�״��)β����ͨ������H2O2�����ټ�����BaCl2��Һ��ַ�Ӧ��(������β���������ɷֵķ�Ӧ)�����ˡ�ϴ�ӡ���������õ�b g������β����SO2�ĺ���(�������)�ļ���ʽ��_____��
(3)H2S�������ڻ��յ�������H2S�Ϳ�����β����һ������ͨ������FeCl3��Һ����ʵ�ֿ������õ�������FeCl3��Һ����H2S�����У���Һ�е�n(Fe3+)�������յ�n(H2S) ��ʱ��t�ı仯��ͼ��

����ͼ����Ϣ��֪��0��t1ʱ��һ�������ķ�Ӧ��_____(�����ӷ���ʽ��ʾ)��
��t1�Ժ���Һ��n(Fe3+)���ֻ������䣬ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��㷺Ӧ���ڲ�������ֽ����֯��ϴ�Ӽ���������
(1)��������Ǵ��μ�غ��κ��л�ô����ԶԶ�������㹤ҵ��չ����Ҫ������Ļ�ѧʽΪ________��
1791�꣬��·�����Ƽ��ȡ��ר�����÷��������ᡢ�Ȼ��ơ�ľ̿������ʯ(��Ҫ�ɷ�Ϊ̼���)Ϊԭ�ϣ�����20����20�������̭����Ϊ�����������ͷų�HCl���壬�������������е�ˮ�������γ���������ʴ�����豸��
(2)1861�꣬������ά�Ƽ���������÷����������Ȼ�����Һ�������ֹ�ҵ����ʱ���ⷢ�ֵģ���Ӧ������̼�����ƺ��Ȼ��(NH4Cl)���ټ���̼�����Ƽ����Ƶô���Ȼ�����Һ���յ���������Ϊ________(����ĸ)��
A��Cl2 B��NH3 C��SO2 D��CO2
(3)�������Ƽ�����ҹ���ѧ����ר�Һ�°�������1943�괴�����Ƕԡ�����ά�Ƽ���ĸĽ����������ȡ̼������ϳɰ�������������������ʳ�ε������ʣ��������������̣������˶Ի�������Ⱦ��������Ϊȫ����㷺���á�
����ͼ��ʾװ�ÿ���ģ�⡰����̼�������Ƶô���Ĺ��̡�
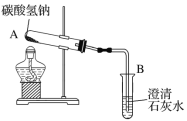
���۲쵽B�г��ֻ���ʱ��ֹͣ���ȣ�A�з�����Ӧ�Ļ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��A��B��C��D��E��ԭ��������������A��Cͬ�壬B��Dͬ�壬C���Ӻ�B���Ӿ�����ͬ�ĵ��Ӳ�ṹ��A��B��D��E�����γɹ����ͻ����A��B�γɵĻ�������ˮ�гʼ��ԣ�C��E�γɵĻ��������ճ������еij��õ�ζƷ���ش��������⣺
(1)����Ԫ���У�ԭ�Ӱ뾶������________���ǽ�������ǿ����________(��Ԫ�ط���)��
(2)��A�ֱ��B��D��E���γɵĹ����ͻ������У����ȶ���������__________(�û�ѧʽ��ʾ)��
(3)A��B��E�γɵ����ӻ��������ʽΪ____________�����д��ڵĻ�ѧ������Ϊ____________��
(4)D����������ˮ����Ļ�ѧʽΪ________________��
(5)����D�ڳ���ĵ���E��ȼ�գ���Ӧ�Ļ�ѧ����ʽΪ__________________��D�ڲ������E��ȼ�գ����ɵ���Ҫ����Ļ�ѧʽΪ__________��
(6)����E��ˮ��Ӧ�����ӷ���ʽΪ____________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com