
已知反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )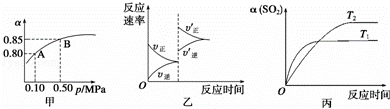
|
| A. | 由图甲知,A点SO2的平衡浓度为0.4 mol/L |
|
| B. | 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 |
|
| C. | 达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
|
| D. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
| 化学反应速率与化学平衡图象的综合应用;体积百分含量随温度、压强变化曲线.. | |
| 专题: | 化学平衡专题. |
| 分析: | A、甲图表示不同压强下到达平衡时,SO2的平衡转化率与压强关系,由甲图可知A点SO2的转化率为0.8,二氧化硫起始浓度乘以转化率为二氧化硫的浓度变化量,据此计算△c(SO2),进而计算二氧化硫的平衡浓度; B、由甲图可知B点SO2的转化率为0.85,二氧化硫起始浓度乘以转化率为二氧化硫的浓度变化量,据此计算△c(SO2),根据三段式进而计算各物质的平衡浓度,据此计算判断; C、达平衡后,缩小容器容积,反应混合物的浓度都增大,正、逆反应速率都增大,体系压强增大,平衡向体积减小的反应移动,据此判断; D、由到达平衡的时间可知,温度为T1,先到达平衡,反应速率快,温度越高反应速率越快. |
| 解答: | 解:A、二氧化硫起始浓度为 B、由甲图可知B点SO2的转化率为0.85,所以△c(SO2)=0.85×0.2mol/L=0.17mol/L,则: 2SO2(g)+O2(g)⇌2SO3(g) 开始(mol/L):0.2 0.1 0 变化(mol/L):0.17 0.085 0.17 平衡(mol/L):0.03 0.015 0.17 所以B点SO2、O2、SO3的平衡浓度之比为0.03:0.015:0.17=6:3:34,故B错误; C、达平衡后,缩小容器容积,反应混合物的浓度都增大,正、逆反应速率都增大,体系压强增大,平衡向体积减小的反应移动,即平衡向正反应移动,故V(正)>V(逆),故C正确; D、由到达平衡的时间可知,温度为T1,先到达平衡,反应速率快,温度越高反应速率越快,故T2<T1,故D错误; 故选C. |
| 点评: | 考查化学平衡图象、化学平衡有关计算、影响化学平衡移动的因素等,难度中等,注意甲图表示不同压强下到达平衡时,SO2的平衡转化率与压强关系. |


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式_____________________________________________________
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
 A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
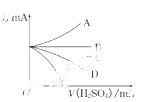
 (3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流 强度I表示)可近似地用右图中的曲线表示是________(填序号).
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流 强度I表示)可近似地用右图中的曲线表示是________(填序号).
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示.向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀H2SO 4至恰好完全反应.在此实验过程中,小球将___________________________________________.
4至恰好完全反应.在此实验过程中,小球将___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.Fe2++SO+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.NH+Fe3++ 2SO+ 2Ba2+ + 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
+ 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
C.2Fe3++ 3SO+ 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
D.3NH+ Fe3++3SO+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:NH4Br(s)═NH3(g)+HBr(g),2HBr(g)fBr2(g)+H2(g).两分钟后,反应达到化学平衡,测知H2浓度为0.5mol•L﹣1,HBr的浓度为4mol•L﹣1,若上述反应速率用v(NH3)表示,下列速率正确的是( )
|
| A. | 0.5 mol•L﹣1•min﹣1 | B. | 2.5 mol•L﹣1•min﹣1 |
|
| C. | 2 mol•L﹣1•min﹣1 | D. | 5 mol•L﹣1•min﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
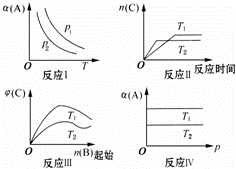
某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)⇌cC(g)表示]化学平衡的影响,得到如图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
分析图象,回答下列问题:
(1)在图象反应Ⅰ中,若p1>p2,则此正反应为 (填“吸热”或“放热”)反应,也是一个气体分子数 (填“减少”或“增大”)的反应,由此判断,此反应自发进行,必须满足的条件是 .
(2)在图象反应Ⅱ中,T1 < T2(填“>”、“<”或“=”),该正反应为 (填“吸热”或“放热”)反应.
(3)在图象反应Ⅲ中,若T2>T1,则此正反应为 (填“吸热”或“放热”)反应.
(4)在图象反应Ⅳ中,若T1>T2,则该反应能否自发进行?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
|
| A. | 漂白粉露置在空气中失效:ClO﹣+CO2+H2O=HClO+HCO3﹣ |
|
| B. | 向NaAlO2溶液中通入过量CO2:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ |
|
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32﹣+2Cl2+3H2O=2SO32﹣+4Cl﹣+6H+ |
|
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+Fe(OH)3=FeO42﹣+3Cl﹣+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
|
| A. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
|
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2﹣、Cl﹣ |
|
| C. | c(H+)=10﹣12mol•L﹣1的溶液:K+、Ba2+、Cl﹣、Br﹣ |
|
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl﹣、I﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在四个脱落标签的试剂瓶中,分别盛有盐酸、BaCl2溶液、Na2CO3溶液、AgNO3溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为:A+B产生无色气体;B+C产生白色沉淀;A+D产生白色沉淀;A+C无明显变化。
(1)由此推出各试剂瓶所盛的试剂为(填化学式):
A:________,B:________,C________,D________。
(2)A+B反应的离子方程式为______________________________。
(3)A+D反应的离子方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com