
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是
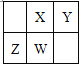
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X > Z > W
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 这四种元素的最高化合价分别与其主族序数相等
【答案】C
【解析】试题分析:在短周期元素中,W原子的质子数是其最外层电子数的三倍,则W是15号的P元素,根据元素在周期表中的相对位置关系可确定:X是N元素,Y是O元素;Z是Si元素。同一周期的元素,原子序数越大,原子半径越小;不同周期的元素,原子核外电子层数越多,原子半径就越大。因此这四种元素的原子半径大小关系是:Z>W>X > Y,故A错误。元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强。由于元素的非金属性:X>W>Z,所以它们的最高价氧化物对应水化物的酸性:X>W>Z,故B错误。元素的非金属性越强,其相应的最简单的氢化物的稳定性就越强。由于元素的非金属性:Y>X>W>Z,所以元素的氢化物的稳定性:Y>X>W>Z,故C正确。除非金属性很强的F、O元素外,一般情况下,元素原子的最外层电子数等于该元素原子的最外层电子数。X、Z、W的最高化合价分别与其主族序数相等,最高化合价分别与其主族序数不相等,故D错误


科目:高中化学 来源: 题型:
【题目】
移取10.00 mL密度为ρg/mL的过氧化氢原溶液稀释成250mL。量取稀过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(1)用高锰酸钾法(一种氧化还原滴定法)可测定待测液中的H2O2的含量。
若需配制浓度为0.10mol·L-1的KMnO4标准溶液500 mL,应准确称取 g KMnO4(已知M(KMnO4)=158.0 g·mol-1)。
a.配制该标准溶液时,下列仪器中不必要用到的有 。(用编号表示)。
①托盘天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
b.定容时仰视读数,导致最终结果____________;(填“偏大”“偏小”或“不变”)
(2)完成并配平离子方程式:
![]() MnO4―+
MnO4―+![]() H2O2+
H2O2+![]() =
=![]() Mn2++
Mn2++![]() O2↑+
O2↑+![]()
(3)滴定时,将高锰酸钾标准溶液注入______________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________________。
(4)重复滴定三次,平均耗用 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为___________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____ _(填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既能用来鉴别甲烷与乙烯,又能用来除去甲烷中的乙烯以提纯甲烷的方法是
A.通过足量的NaOH溶液 B.通过足量的溴水
C.在Ni催化、加热条件下通入H2 D.通过足量的酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是
A. CO2 B. NH3 C. Cl2 D. H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 ℃的下列四种溶液, 其中碱性最强的是( )
A. pH=11的溶液 B. 4 g NaOH溶于水形成1L的水溶液
C. c(OH-)=0.12 mol·L-1 D. c(H+)=1×10-10 mol·L-1的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于细胞中化学元素和化合物的叙述,正确的是
A. 微量元素在生物体内不可缺少,如叶绿素的组成就离不开Mg元素
B. 细胞中绝大部分的水以游离的形式存在,是细胞结构的重要组成成分
C. 由m条肽链、n个氨基酸组成的蛋白质至少含有n—m个肽键
D. 构成蛋白质、核酸、淀粉等生物大分子的单体在排列顺序上都具有多样性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法中,正确的是
A.2.7g金属铝变成铝离子时失去的电子数目为0.1NA (提示:M(Al)=27g/mol)
B.17g氨气所含的电子数目为10NA (提示:M(NH3)=17g/mol)
C.2g氢气所含原子数目为NA (提示:M(H2)=2g/mol)
D.常温常压下,11.2L氮气所含的原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在气体参加的反应中,能使反应物中活化分子数和活化分子百分数都增大的方法是
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂 ⑤移去生成物
A.①②③ B.②③④ C.①③④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化溶质质量分数为36.5%的盐酸.反应方程式如下:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(1)若此盐酸的密度为1.2g/cm3,其物质的量浓度为____________
(2)用双线桥法表示电子的转移情况____________
(3)此反应中氧化剂与还原剂的物质的量的比为____________
(4)15.8g KMnO4完全反应,产生标准状况下Cl2的体积为___________,反应中转移电子的数目为____________(用NA表示阿伏加德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com