
| A. | 三种气体CO、CO2、O3分别都含有1mol O,则三种气体的物质的量之比为3:2:1 | |
| B. | ng Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2L X气体分子的质量为16g,则X气体的摩尔质量是32 | |
| D. | 30g CO和22.4L CO2中含有的碳原子数一定相等 |
分析 A.根据原子守恒知,三种气体CO、CO2、O3分别都含有1mol O,则三种气体的物质的量分别为1mol、0.5mol、$\frac{1}{3}$mol;
B.ng氯气的物质的量=$\frac{ng}{71g/mol}$=$\frac{n}{71}$mol,每个氯分子中含有2个氯原子,所以氯分子个数为0.5m,根据NA=$\frac{N}{n}$计算;
C.摩尔质量的单位是g/mol;
D.气体摩尔体积受温度和压强影响,温度和压强未知时无法确定气体摩尔体积,导致无法计算二氧化碳物质的量.
解答 解:A.根据原子守恒知,三种气体CO、CO2、O3分别都含有1mol O,则三种气体的物质的量分别为1mol、0.5mol、$\frac{1}{3}$mol,所以三种气体物质的量之比=1mol:0.5mol:$\frac{1}{3}$mol=6:3:2,故A错误;
B.ng氯气的物质的量=$\frac{ng}{71g/mol}$=$\frac{n}{71}$mol,每个氯分子中含有2个氯原子,所以氯分子个数为0.5m,根据NA=$\frac{N}{n}$=$\frac{0.5m}{\frac{n}{71}mol}$=$\frac{35.5m}{n}$/mol,故B正确;
C.摩尔质量的单位是g/mol,则该气体摩尔质量是32g/mol,故C错误;
D.气体摩尔体积受温度和压强影响,温度和压强未知时无法确定气体摩尔体积,导致无法计算二氧化碳物质的量,所以无法比较二者中C原子个数是否相等,故D错误;
故选B.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,注意气体摩尔体积适用范围及适用条件,易错选项是D.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应产物的总能量大于反应物的总能量时,△H<0 | |
| B. | 已知反应H2(g)+I2(g)?2HI(g)平衡常数为K,则2H2(g)+2I2(g)?4HI(g)的平衡常数为2K | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,不能改变化学反应进行的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①可表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②可表示对“2SO2(g)+O2(g)?2SO2 (g)△H<0”的平衡体系改变T、P后反应物转化率的变化 | |
| C. | 图③可表示使用催化剂对可逆反应C(s)+H2O(g)?CO(g)+H2(g)的影响 | |
| D. | 图④表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | 气态氢化物稳定性:Z>W | |
| B. | 简单离子半径:X<Y | |
| C. | 液态WZ4气化需克服分子间作用力 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
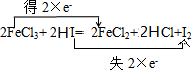 ,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.
,当有0.1mol的Fe2+生成时,转移电子数目为0.1NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量稀盐酸无沉淀,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 无色试液加入NaOH溶液,试管口湿润的红色石蕊试纸未变蓝,结论:试液中无NH4+ | |
| D. | 无色溶液中加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等优良的性能.
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等优良的性能.| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度(mol•L-1) | 0.44 | 0.60 | 0.60 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2mol H2 | 1mol CH3OH | 2mol CO、4mol H2 |
| CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α2 | α3 |
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K4 | K5 | K6 | K7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com