
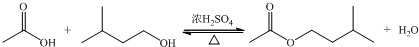
| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |

分析 在装置A中加入反应混合物和2~3片碎瓷片,开始缓慢加热A,利用冷凝管冷凝回流50分钟,反应液冷至室温后,倒入分液漏斗中,先用少量水洗掉大部分硫酸和醋酸,再用水洗涤碳酸氢钠溶液,分出的产物加入少量无水硫酸镁固体作干燥剂,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯,还考查了反应物转化率的提高方法,同时进行产率的计算有误差分析.
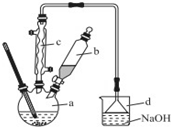
(1)根据题中仪器B的构造判断该仪器的名称;
(2)根据乙酸异戊酯的密度及正确的分液操作方法进行解答;
(3)根据反应物对增加一种反应物的浓度,可以使另一种反应物的转化率提高进行判断加入过量乙酸的目的;
(4)少量无水硫酸镁能够吸收乙酸异戊酯中少量的水分,起到干燥作用;
(5)先根据温度计在蒸馏操作中的作用排除ad,再根据球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,得出正确结论;
(6)先计算出乙酸和异戊醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成乙酸异戊酯的物质的量,最后根据实际上制取的乙酸异戊酯计算出产率;
(7)若从130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,导致获得的乙酸异戊酯质量偏大.
解答 解:(1)由装置中仪器B的构造可知,仪器B的名称为球形冷凝管,
故答案为:球形冷凝管;
(2)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d,
故答案为:d;
(3)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种反应物的浓度,可以使另一种反应物的转化率提高,因此本实验中加入过量乙酸的目的是提高转化率,
故答案为:提高醇的转化率;
(4)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对乙酸异戊酯进行干燥,
故答案为:干燥;
(5)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以ad错误;c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此仪器及装置安装正确的是b,
故答案为:b;
(6)乙酸的物质的量为:n=$\frac{6.0g}{60g/mol}$=0.1mol,异戊醇的物质的量为:n=$\frac{4.4g}{88g/mol}$=0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为=$\frac{3.9g}{130g/mol}$=0.03mol,所以实验中乙酸异戊酯的产率为:$\frac{0.03}{0.05}$×100%=60%,
故答案为:d;
(7)在进行蒸馏操作时,若从130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,因此会导致产率偏高,
故答案为:高.
点评 本题为一道高考题真题,考查了常见仪器的构造与安装、混合物的分离、提纯、物质的制取、药品的选择及使用、物质产率的计算等知识,题目难度较大,试题涉及的题量较大,知识点较多,充分培养了学生的分析、理解能力及灵活应用所学知识的能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:实验题
 | 初始pH | V(KMnO4)/mL | V(H2C2O4)/mL | V(H2O)/mL |
| ① | 4 | 20 | 10 | |
| ② | 5 | 10 | 5 | |
| ③ | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 丙烯酸乙酯(CH2═CHCOOCH2CH3,密度为0.94g/mL)可广泛用于涂料、粘合剂的制造、皮革加工等方面.某实验小组利用如图所示的装置合成丙烯酸乙酯(部分夹持及加热装置已省略).
丙烯酸乙酯(CH2═CHCOOCH2CH3,密度为0.94g/mL)可广泛用于涂料、粘合剂的制造、皮革加工等方面.某实验小组利用如图所示的装置合成丙烯酸乙酯(部分夹持及加热装置已省略).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l04,则转化后所得溶液的pH=1 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
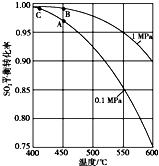 硫酸工业的生产工艺流程可简略表示如下:
硫酸工业的生产工艺流程可简略表示如下: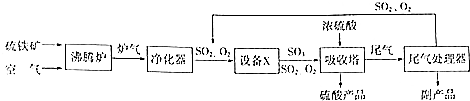 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,反应就停止了,即正逆反应速率为零 | |
| C. | 在达到平衡的体系中,充入O2,对化学平衡无影响 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应所能达到的限度两个方面的问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com