
【题目】粉煤灰(主要含有 SiO2、Fe2O3、Al2O3 等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有 很大的价值。
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。
①写出硫酸溶液与 Fe2O3 反应的离子方程式_____。
②初步分离得到的滤渣主要成分是_____。
(2)向(1)分离所得的滤液中加入还原剂使 Fe3+转化为 Fe2+,结合下表分析其原因____。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验。
①氨水使滤液中铝离子沉淀的离子方程式为_____。
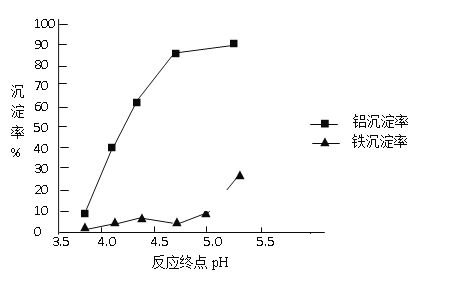
②反应终点的pH对铝和铁分离效果的影响如下图。根据实验结果,为达到好的分离效果,反应过程中控制pH的 范围是______________,选择该范围的理由是___________________。
Ⅱ.NH4HSO4和H2SO4按物质的量比1∶1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵 [NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3。 已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g。②280℃时分解。
(1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是_____。
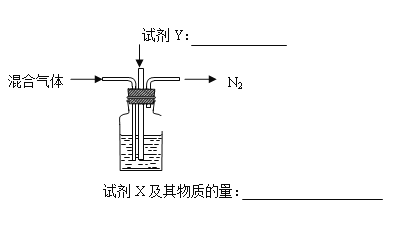
(2)煅烧 NH4Al(SO4)2 同时得到混合气体(NH3、N2、SO2、SO3、H2O)。若 16 mol 混合气体按如下装置被完全吸收制得浸取液,请将下图中试剂(化学式)及其物质的量补充完整。____________,___________
4NH4Al(SO4)2 ![]() 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
【答案】6H++Fe2O3![]() 2Fe3++3H2OSiO2Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离3NH3·H2O+Al3+
2Fe3++3H2OSiO2Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离3NH3·H2O+Al3+![]() Al(OH)3↓+3NH4+略小于5铝元素沉淀较多,铁元素还没有开始大量的沉淀冷却、结晶试剂Y:O2试剂X及其物质的量:含2mol溶质的氨水
Al(OH)3↓+3NH4+略小于5铝元素沉淀较多,铁元素还没有开始大量的沉淀冷却、结晶试剂Y:O2试剂X及其物质的量:含2mol溶质的氨水
【解析】
Ⅰ.(1)①硫酸与氧化铁反应生成硫酸铁和水,离子方程式为:6H++Fe2O3![]() 2Fe3++3H2O;综上所述,本题答案是:6H++Fe2O3
2Fe3++3H2O;综上所述,本题答案是:6H++Fe2O3![]() 2Fe3++3H2O。
2Fe3++3H2O。
②硫酸将氧化铁和氧化铝溶解,生成铁离子和铝离子,二氧化硅不与硫酸反应,初步分离得到的滤渣主要成分是SiO2;综上所述,本题答案是:SiO2。
(2)Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离,将Fe3+转化为Fe2+后,Fe(OH)2的沉淀pH与Al(OH)3相差较大,便于分离;综上所述,本题答案是:Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离。
(3)①一水合氨是弱碱,与铝离子反应生成氢氧化铝沉淀,反应的离子方程式为:3NH3·H2O+Al3+![]() Al(OH)3↓+3NH4+;综上所述,本题答案是:3NH3·H2O+Al3+
Al(OH)3↓+3NH4+;综上所述,本题答案是:3NH3·H2O+Al3+![]() Al(OH)3↓+3NH4+。
Al(OH)3↓+3NH4+。
②由图可知:pH略小于5时,Al的沉淀率较高(接近90%),而Fe的沉淀率较低(小于10%),当pH大于5时,Fe的沉淀率突然增大,且Al的沉淀率无明显变化,所以反应过程中控制pH略小于5;综上所述,本题答案是:略小于5,铝元素沉淀较多,铁元素还没有开始大量的沉淀。
Ⅱ.(1)根据NH4Al(SO4)2 在0℃和100℃时溶解度变化可知NH4Al(SO4)2 的溶解度受温度影响较大,温度较低时溶解度较低,选用冷却、结晶的方法将NH4Al(SO4)2 与其他溶质分离;综上所述,本题答案是:冷却、结晶。
(2)根据已知可知浸取液中硫元素的存在形式为SO42-;由图可知最终排放的气体只有N2,则其他气体均被吸收,且硫元素最终转化为SO42-,把SO2氧化为SO42-,所以气体Y是O2;根据化合价升降守恒,煅烧NH4Al(SO4)2 的化学方程式为: 4NH4Al(SO4)2 ![]() 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑;据以上反应可知4mol NH4Al(SO4)2煅烧生成16mol气体,其中3molSO2 、5molSO3溶于水后,经过氧气氧化,最终溶液中含有8mol SO42-;2molNH3通入瓶中,最终转化为2molNH4+,又因为NH4HSO4和H2SO4按照物质的量比1:1配成浸取液,根据SO42-的物质的量可知,共需要4molNH4HSO4,除去氨气转化生成的2molNH4+,还需要2molNH4+,因此加入的试剂X是含2mol溶质的氨水;综上所述,本题答案是:试剂Y:O2;试剂X及其物质的量:含2mol溶质的氨水。
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑;据以上反应可知4mol NH4Al(SO4)2煅烧生成16mol气体,其中3molSO2 、5molSO3溶于水后,经过氧气氧化,最终溶液中含有8mol SO42-;2molNH3通入瓶中,最终转化为2molNH4+,又因为NH4HSO4和H2SO4按照物质的量比1:1配成浸取液,根据SO42-的物质的量可知,共需要4molNH4HSO4,除去氨气转化生成的2molNH4+,还需要2molNH4+,因此加入的试剂X是含2mol溶质的氨水;综上所述,本题答案是:试剂Y:O2;试剂X及其物质的量:含2mol溶质的氨水。


科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是:
A.铝片与稀盐酸反应B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的碳与CO反应D.甲烷在氧气中燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A. FeBr2溶液中加入等物质的量的Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3++Br2+4Cl-
B. 用氢氟酸在玻璃上“刻字”:SiO2 + 4H+ + 4F- = SiF4↑+ 2H2O
C. 将铜丝投入稀硝酸中:Cu + 4H+ + 2NO3-= Cu2+ + 2NO2↑+ 2H2O
D. NaOH与NH4Cl溶液混合加热:NH4+ + OH- ![]() NH3·H2O
NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸.请根据以上信息回答下列问题.
(1)C元素在元素周期表中的位置是________________
(2)画出B元素的离子结构示意图______________
(3)与E的氢化物分子所含电子总数相等的分子是_____(举一例,填化学式,下同)、离子是_________
(4)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为_________
(5)写出A元素与B元素形成化合物的化学式________
(6)下列可以判断C和D非金属性强弱的是_______
a.单质的熔点C比D低 b.单质与氢气反应C比D剧烈
c.气态氢化物稳定性C比D稳定 d.单质的密度C比D小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为__________________________。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
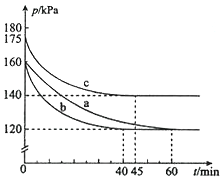
①实验a从反应开始至达到平衡时的反应速率v(AX5)=________(保留两位有效数字)。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为___________ (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:
b____________________、c____________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢钠广泛地应用于生产、实验和日常生活中。某课外小组同学通过查阅资料对碳酸氢钠的性质和制法进行了系列实验,请你参与探究。
(1)向NaHCO3溶液滴加MnCl2溶液生成沉淀MnCO3,离子方程式为______。
(2)向NaHCO3溶液加入少量的镁粉,观察到有气体和白色沉淀生成,则该气体一定是______(填化学式),白色沉淀可能是:①MgCO3;②Mg(OH)2;③Mg2(OH)2CO3。欲证明白色沉淀为②,简单的实验方法为______(操作、现象和结论)。
(3)电解Na2CO3溶液制NaHCO3的原理如图—1所示.
①电解初期,电解池中总反应方程式为______。
②若电解过程中透过交换膜的Na+为 0.4 mol,则阳极收集到 O2_____L(标况)。
③电解后期溶液中的含碳微粒逐渐减少,此阶段阳极反应式为______。
(4) “侯氏制碱法”的原理是: NaCl+NH3+ CO2+H2O= NaHCO3+NH4Cl,模拟该制法的部分装置如图—2所示.
① 正确的操作是______(填序号)。
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b通入NH3,然后a通入CO2,c中放碱石灰
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
② 水槽中的冷水起降温作用,这样有利于______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图示装置制备KC1O溶液,再与KOH、Fe(NO3)3溶液反应制备髙效净水剂K2FeO4。

<査阅资料>O2与KOH溶液在20℃以下反应生成KC1O,在较高温度下则生成KC1O3;K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称是___________;装置A中反应的离子方程式为___________________。
装置C中三颈烧瓶置于冰水浴中的目的是_______________。
(2)装置B吸收的气体是___________,装置D的作用是____________________。
(3)C中得到足量KC1O后,将三颈烧瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为________________。再加入饱和KOH溶液,冷却至0℃~5℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KC1等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/LKOH溶液中。
②过滤。
③____________________。
④搅拌、静置、过滤,用乙醇洗涤2~3次,
⑤在真空干燥箱中干燥。
(5)称取提纯后的K2FeO4样品0.2200 g于烧杯中,加入强碱性NaCr(OH)溶液,反应后再加稀H2SO4调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:
Cr(OH)4-+FeO42- =Fe(OH)3↓+CrO42-+OH-
2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
则该K2FeO4样品的纯度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的是

A. 相同条件下,K(s)的(ΔH2′+ΔH3′)<Na(s)的(ΔH2+ΔH3)
B. ΔH4的值数值上和Cl-Cl共价键的键能相等
C. ΔH5<0,在相同条件下,2Br(g)的ΔH5′>ΔH5
D. ΔH7<0,且该过程形成了分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元化合物X是锂硫电池的电极材料,为探究其组成进行了如下实验:
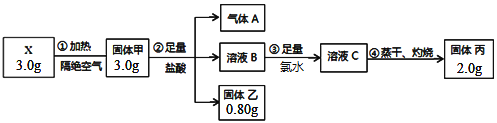
固体乙是一种单质,固体丙呈红棕色,将气体A通入溶液C中也能生成固体乙。
请回答:
(1)X的化学式是_________________,步骤①的化学方程式是_________________________。
(2)气体A通入溶液C发生反应的离子方程式是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com