
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3 ,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7 ·2H2O),其主要工艺流程如下图:
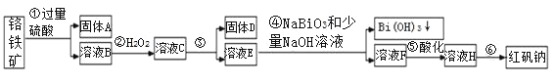
查阅资料得知:
i.常温下,NaBiO3 不溶于水,有强氧化性,在碱性条件下,能将 Cr 3+ 转化为CrO42- 。
ii.
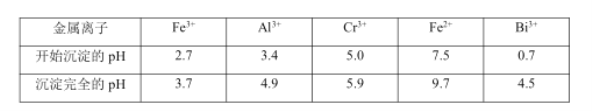
回答下列问题:
(1)步骤③加的试剂为氢氧化钠溶液,此时溶液 pH 要调到5的目的是_________ 。
(2)写出④反应的离子反应方程式:________________
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是____________ (填操作名称)。
(4)取一定质量的固体 D 溶解于 200mL 的硫酸中,向所得溶液中加入5mol/L 的NaOH 溶液,生成沉淀的物质的量n与加入NaOH 溶液的体积V 关系如图所示,则硫酸的浓度为_______ ,固体 D 中含铁化合物的物质的量为__________ 。

Ⅱ.经检测该化工厂的工业废水中含 5.00×10 -3 mol·L -1 的 Cr2O72- ,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4 (Fe 的化合价依次为+3、+2),又设计了如下工艺流程:

(1)第①步反应的离子方程式_______________ 。
(2)欲使 1L 该废水中的 Cr2O72- 完全转化为 Cr 0.5 Fe 1.5 FeO4 。理论上需要加FeSO4 ·7H2O 的质量为 ________g (已知 FeSO 4 ·7H2O 的摩尔质量为 278g/mol)。
【答案】使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去 3NaBiO3+2Cr3++7OH+H2O=2CrO42+3Na++3Bi(OH)3 重结晶 2.5mol/L 0.1mol Cr2O72-+14H++6Fe2+=2Cr3+ +6Fe3++7H2O 13.9
【解析】
Ⅰ.铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质),加入过量稀硫酸,固体A为SiO2,溶液B中含有Cr3+、Al3+、Fe2+,在B中加入过氧化氢,可生成Fe3+,调节溶液pH可除去Fe3+、Al3+,生成氢氧化铁、氢氧化铝沉淀,即固体D,溶液E含有Cr3+,在溶液E中加入NaBiO3和NaOH,发生氧化还原反应,固体G为Bi(OH)3,溶液F含有Na2CrO4,酸化可得Na2Cr2O7,溶液经蒸发浓缩、冷却结晶可得Na2Cr2O72H2O,以此解答该题。
Ⅱ.Cr2O72-有较强氧化性,FeSO47H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据守恒元素守恒及所处环境可知,还应有水生成.再根据电子转移守恒、电荷守恒、原子守恒配平;根据Cr原子计算Cr0.5Fe1.5FeO4的物质的量,结合Cr0.5Fe1.5FeO4的物质的量,利用Fe原子守恒计算FeSO47H2O质量。
(1)根据表格数据分析,步骤③加的试剂为氢氧化钠溶液,此时溶液pH要调到5的目的使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去,而铬离子不沉淀,
故答案为:使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去;
(2)在溶液E中加入NaBiO3和NaOH,发生氧化还原反应,固体G为Bi(OH)3,反应的离子方程式为3NaBiO3+2Cr3++7OH+H2O=2CrO42+3Na++3Bi(OH)3,
故答案为:3NaBiO3+2Cr3++7OH+H2O=2CrO42+3Na++3Bi(OH)3;
(3)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,此操作为重结晶,
故答案为:重结晶;
(4)由图象可知加入NaOH200mL时沉淀完全,此时溶液为![]() ,则
,则![]() ,
,![]() ,加入
,加入![]() 200mL~240mL时发生
200mL~240mL时发生![]() ,则
,则![]() ,从20mL到200mL,生成
,从20mL到200mL,生成![]() 和
和![]() ,
,![]() ,所以固体D中含
,所以固体D中含![]() 化合物的物质的量为0.1mol,
化合物的物质的量为0.1mol,
故答案为:2.5mol/L;0.1mol;
Ⅱ. (1) Cr2O72-有较强氧化性,FeSO47H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,实验流程可知,第①步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+ ,根据元素守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O72-+14H++6Fe2+=2Cr3+ +6Fe3++7H2O,
故答案为:Cr2O72-+14H++6Fe2+=2Cr3+ +6Fe3++7H2O;
(2) 1L废水中含n(Cr2O72-) = 5.00×10-3mol,根据Cr原子、Fe原子守恒,可得Cr2O72-~ 4Cro.5Fe1.5FeO4 ~ 10FeSO47H2O,所以理论上n(FeSO47H2O)= 10n(Cr2O72-)=5.00×10-3mol ×10= 0.05mol,所以m(FeSO47H2O) = 0.05mol ×278g/mol = 13.9g,
故答案为:13.9。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A.Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g),常压下该反应在1900℃的高温下才能进行,说明该反应的ΔH<0
B.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
C.将MgCl2·6H2O在坩埚中加热可获得MgCl2
D.反应2H2(g)+O2(g)![]() 2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和反应中断裂旧共价键的键能之和
2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和反应中断裂旧共价键的键能之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 增大
增大
B.在0.1mol/LCH3COONa溶液中:n(OH﹣)+0.1mol>n(CH3COOH)+n(H+)+n(Na+)
C.在10mL0.1mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)<Ksp(AgCl)
D.常温下,10mL0.02mol/LHCl溶液与10mL0.02mol/LBa(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000mol/L NaOH溶液滴定 20.00mL0.1000mol/L某一元酸HA溶液,滴定曲线如图。下列说法正确的是
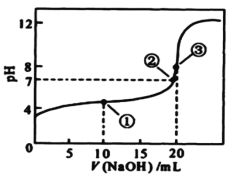
A.该滴定过程既能用甲基橙又能用酚酞作指示剂
B.点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C.点②所示溶液中:c(Na+) =c(HA) +c(A-)
D.水的电离程度随着NaOH溶液的滴入不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的数目相等的是()
A.等物质的量的水与重水含有的中子数
B.等质量的乙烯和丙烯中含有的共用电子对数
C.等质量的12C18O和14N2含有的质子数
D.等体积的pH=5的盐酸和pH=5的氯化铵溶液中,由水电离出来的氢离子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、W、X、Y、Z的原子序数依次增大,R的简单氢化物可用作制冷剂,X是短周期中金属性最强的元素。Y的简单离子在同周期元素的简单离子中半径最小,由W、X和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀(Z的单质)析出,同时产生有刺激性气味的气体(Z的氧化物)。下列说法正确的是( )
A. 原子半径:Z>Y>X>W
B. Z的简单氢化物的热稳定性比W的强
C. Y的氧化物既可溶于R的最高价氧化物对应的水化物水溶液,也可溶于R的氢化物水溶液
D. X与W、Z形成的化合物不少于三种
查看答案和解析>>
科目:高中化学 来源: 题型:
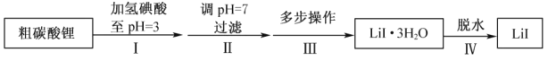
【题目】碘化锂(![]() )在能源、医药等领域有重要应用,某兴趣小组制备
)在能源、医药等领域有重要应用,某兴趣小组制备![]() 和
和![]() ,流程如下:
,流程如下:
已知:![]() 在75~80℃转变成
在75~80℃转变成![]() ,80~120℃转变成
,80~120℃转变成![]() ,300℃以上转变成无水
,300℃以上转变成无水![]() 。
。
b.![]() 易溶于水,溶解度随温度升高而增大。
易溶于水,溶解度随温度升高而增大。
c.![]() 在空气中受热易被氧化。
在空气中受热易被氧化。
请回答:
(1)步骤II,调![]() ,为避免引入新的杂质,适宜加入的试剂为________。
,为避免引入新的杂质,适宜加入的试剂为________。
(2)步骤III,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作。
下列说法正确的是________。
A.为得到较大的![]() 晶体颗粒,宜用冰水浴快速冷却结晶
晶体颗粒,宜用冰水浴快速冷却结晶
B.为加快过滤速度,得到较干燥的晶体,可进行抽滤
C.宜用热水洗涤
D.可在80℃鼓风干燥
(3)步骤IV,脱水方案为:将所得![]() 置入坩埚中,300℃加热,得
置入坩埚中,300℃加热,得![]() 样品。用沉淀滴定法分别测定所得
样品。用沉淀滴定法分别测定所得![]() 、
、![]() 样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调
样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调![]() ,用滴定管中的
,用滴定管中的![]() 标准溶液滴定至终点,根据消耗的
标准溶液滴定至终点,根据消耗的![]() 标准溶液体积计算,得
标准溶液体积计算,得![]() 、
、![]() 的纯度分别为99.96%,95.38%。
的纯度分别为99.96%,95.38%。![]() 纯度偏低。
纯度偏低。
①上述测定过程提及的下列仪器,在使用前一定不能润洗的是________。
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②测定过程中使用到移液管,选出其正确操作并按序列出字母:
蒸馏水洗涤→待转移溶液润洗→________→_______→_______→_______→洗净,放回管架。
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液设备
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
③![]() 纯度偏低,可能的主要杂质是________。
纯度偏低,可能的主要杂质是________。
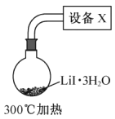
(4)步骤IV,采用改进的实验方案(装置如图),可以提高![]() 纯度。
纯度。
①设备X的名称是________。
②请说明采用该方案可以提高![]() 纯度的理由________。
纯度的理由________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铜和浓硫酸的反应,下列装置或操作错误的是
甲 乙
乙  丙
丙
A.上下移动装置甲中的铜丝可控制SO2的生成
B.装置乙可用于收集SO2气体
C.为确认甲中有CuSO4生成,向甲中反应后的试管中直接加水稀释,观察溶液颜色
D.利用装置丙将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4·5H2O晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁与氯气的反应,某同学甲设计了如下的实验方案及步骤。

实验装置图
(1)用注射器吸取20 mL左右的________(填化学式)。
(2)按图所示连接实验装置,并固定在铁架台上。经检验装置不漏气。在硬质玻璃管内加入一定量的细铁丝,一支试管内加入硫氰化钾溶液,另一支试管中加入氢氧化钠溶液。
(3)加热硬质玻璃管内铁丝约1 min,然后把注射器中的氯气注入到硬质玻璃管内,观察实验现象。硬质玻璃管内可观察到产生__________色的烟,盛硫氰化钾溶液的试管内显____________。
(4)请写出加入硫氰化钾溶液试管中所发生反应的离子方程式:_____________________。其中,氢氧化钠溶液的作用是______________。
(5)某同学取适量生成物溶于水得50.0mL溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。则溶液中c(Cl-)=__________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com