
| A、容量瓶事先没有烘干 |
| B、定容时观察液面俯视 |
| C、定容时观察液面仰视 |
| D、转移液体至容量瓶时有少量液体流出 |
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在“研究反应速率的影响因素”实验中:Na2S2O3+H2SO4=Na2SO4+S+SO2+H2O,可通过观察产生气泡的快慢来比较不同条件下该反应的速率大小 |
| B、为了精确测定盐酸与氢氧化钠溶液反应的反应热,当两者混合后,立即读取温度计的读数,防止热量散失 |
| C、将铁粉、碳粉、少量氯化钠和水混合放在塑料袋中搓揉,用手触摸会感觉到发热,袋里产生大量铁锈 |
| D、酸碱中和滴定实验中,终点判断过迟,导致标准液滴多,只能重新滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
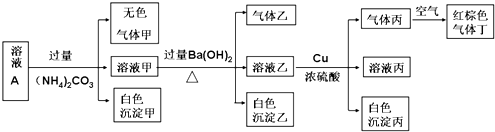
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 蒸发皿、酒精灯 | 蒸发NaCl溶液得到晶体 |
| B | 漏斗、滤纸 | 从CaCO3浊液中分离出CaCO3 |
| C | 托盘天平、胶头滴管 | 用NaCl固体配制1mol?L-1的溶液 |
| D | 分液漏斗 | 用CCl4萃取碘水中的碘 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置可用于蒸发氯化镁溶液得到无水氯化镁 |
B、 装置可用于铜和稀硝酸制取并收集少量NO |
C、 装置可用于证明铁生锈氧气参与反应 |
D、 苯萃取碘水中的碘后,从装置下口放出的是碘的苯溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制铁:以铁矿石为原料,在高温条件下用CO还原得到铁单质 |
| B、制镁:用海水为原料,经一系列过程制得氧化镁固体,电解熔融的氧化镁得到镁单质 |
| C、制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液得到金属钠 |
| D、制铝:从铝土矿中,经一系列反应得到氯化铝,电解熔融的氯化铝得到金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com