
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用。请回答下列问題:
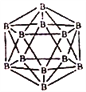
(1)区分晶体硼和无定形硼最可靠的科学方法为________。晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图)。若每个单元中有两个原子为10B,其余为11B,则该单元结构的类型有___种。
(2)NaBH4是一种重要的储氢载体,阴离子结构式为________。
(3)图1表示多硼酸根的一种无限长的链式结构,其化学式可表示为____(以n表示硼原子的个数)。
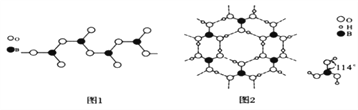
(4)硼酸晶体是片层结构,有与石墨相似的层状结构,图2表示的是其中一层的结构。硼酸晶体中存在的作用力有共价键、________、________。与H3BO3酸性最接近的是________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是____________________。
(5)镁的堆积方式为________________,配位数为________。
【答案】 X-射线衔射实验 3 ![]() (BO2)nn-或BO2- 氢键 范德华力 A 晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,溶解度增大 六方最密堆积 12
(BO2)nn-或BO2- 氢键 范德华力 A 晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,溶解度增大 六方最密堆积 12
【解析】(1)区分晶体硼和无定形硼最可靠的科学方法为进行X-射线衔射实验。晶体硼的结构单元是正二十面体,每个单元中有12个硼原子。若其中有两个原子为10B,其余为11B,该结构单元结构类型取决于两个10B原子的相对位置,两个10B有相邻、相间、相对,所以共有3种类型结构。(2)NaBH4是一种重要的储氢载体,阴离子的化学式为BH4-,则其结构式为![]() 。(3)从图可看出,每个BO32-单元,都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个BO32-单元共用,所以B:O=1:(1+2×1/2)=1:2,化学式为BO2-;(4)根据石墨的结构可知硼酸晶体中存在的作用力有共价键、范德华力,另外氧原子与氢原子还形成氢键。H3BO3可改写为(HO)3B,非羟基氧原子数为0。A.H4SiO4可改写为(HO)4Si,非羟基氧原子数为0;C.H3PO4可改写为(HO)3PO,非羟基氧原子数为1;D.HNO2可改写为(HO)NO,非羟基氧原子数为1,非羟基氧原子数相同,酸性相近,故A符合;答案选A;由于晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,溶解度增大,所以硼酸晶体在冷水中溶解度很小,但在热水中较大。(5)镁的堆积方式为六方最密堆积,配位数为12。
。(3)从图可看出,每个BO32-单元,都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个BO32-单元共用,所以B:O=1:(1+2×1/2)=1:2,化学式为BO2-;(4)根据石墨的结构可知硼酸晶体中存在的作用力有共价键、范德华力,另外氧原子与氢原子还形成氢键。H3BO3可改写为(HO)3B,非羟基氧原子数为0。A.H4SiO4可改写为(HO)4Si,非羟基氧原子数为0;C.H3PO4可改写为(HO)3PO,非羟基氧原子数为1;D.HNO2可改写为(HO)NO,非羟基氧原子数为1,非羟基氧原子数相同,酸性相近,故A符合;答案选A;由于晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,溶解度增大,所以硼酸晶体在冷水中溶解度很小,但在热水中较大。(5)镁的堆积方式为六方最密堆积,配位数为12。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)相同温度和压强下,等质量的SO2和O2。二者体积比为________,分子个数比为________,密度比为________。
(2)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,某容器装满CO2时总质量为88.8 g,而将此容器装满O2时其总质量为 86.4 g,则此容器的容积为
A.1.12 LB.2.24 LC.3.36LD.4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知![]() =0.58)。下列分析不正确的是
=0.58)。下列分析不正确的是

A. a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态
B. 饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-)
C. 饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊
D. 石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,其产量用来衡量一个国家石油化工发展水平,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。

(1) A的名称为____;C分子中的官能团名称为_________。
(2)反应③的化学方程式为_________;该反应的反应类型为_________。
(3)反应④的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色
C. 对2 HI(g)![]() H2(g) + I2(g)平衡体系增大压强使气体颜色变深
H2(g) + I2(g)平衡体系增大压强使气体颜色变深
D. 溴水中有下列平衡Br2 + H2O![]() HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6 mol·L-l
B. HCOO-的水解常数为1.0×10-10
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O的平衡常数K=100
=Zn2++2HCOO-+2H2O的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组测定某蛋白质的组成(假定只含C、H、O、N元素),设计如下实验(夹持装置略去)。
I.样品中碳、氢含量的测定

(1)仪器a的名称为___________________________。
(2)导管g的作用为______________________________________。
(3)选择上述装置,按气流从左到右的方向,合理的连接顺序为____________________(填大写字母,仪器可重复使用)→排水法收集气体装置。
(4)称取4.65g蛋白质样品,用上述连接好的装置进行实验。
①充分反应后,熄灭D处酒精灯之前,需继续通入O2至硬质玻璃管冷却,原因为__________________。
②充分反应后,测得用于接收气体产物的碱石灰和P2O5分别增重7.7g、2.25g。
Ⅱ.样品中氮元素含量的测定
已知:在催化剂存在下,浓硫酸能将样品中的氮元素转化为铵盐。
i.重新称取4.65g蛋白质样品,将其中的氮元素全部转化为铵盐;
ii.所得铵盐与足量NaOH溶液反应,并用100mLl mol·L-l盐酸将生成的氨气全部吸收;
iii.将吸收液稀释至500mL;
iv.取25.00mL稀释后的溶液,用0.1000 mol·L-l的NaOH溶液平行滴定,平均消耗标准液25.00mL。
(5)蛋白质样品中C、H、N、O的原子数目之比为_____________________。若步骤iii中定容时仰视容量瓶刻度线,则所测氮元素含量___________(填“偏高”“偏低”或“无影响”)。
(6)有同学认为,通过(3)中收集到的气体体积即可得到氮元素的含量,你认为其观点___________(填“正确”或“不正确”),理由为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Pb电极电解含有Cu2+和X3+均为0.1mol的溶液,阴极析出金属的质量m与溶液中通过电子的物质的量n关系如图,则离子的氧化性能力由大到小排列正确的是( )

A. Cu2+>X3+>H+ B. H+>X3+>Cu2+
C. X3+>H+>Cu2+ D. Cu2+>H+>X3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com