
”¾ĢāÄæ”æÓŠ¹ŲĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø²æ·ÖĪļÖŹÓėĢõ¼žŅŃĀŌČ„£©£®A”¢C”¢E”¢GŹĒ ֊ѧ»Æѧ֊³£¼ūµÄµ„ÖŹ£ŗĶس£×“æöĻĀ£¬EŹĒĆܶČ×īŠ”µÄĘųĢ壬GŹĒ»ĘĀĢÉ«µÄĘųĢ壬B ŹĒ³£¼ūµÄĪŽÉ«ŅŗĢ壬FĪŖĒæ¼ī£¬DŹĒijÖÖ¾ßÓŠ“ÅŠŌµÄ½šŹōæóĪļµÄÖ÷ŅŖ³É·Ö£¬KŹÜČČ·Ö½āæÉÉś³Éŗģ×ŲÉ«¹ĢĢ壮 
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©DµÄ»ÆѧŹ½ĪŖ
£Ø2£©HµÄµē×ÓŹ½ĪŖ
£Ø3£©Š“³öAÓėB·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ
£Ø4£©Š“³ö³£ĪĀĻĀGÓėFµÄČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ £®
”¾“š°ø”æ
£Ø1£©Fe3O4
£Ø2£©![]()
£Ø3£©2Na+2H2O=2NaOH+H2”ü
£Ø4£©Cl2+2OH©=Cl©+ClO©+H2O
”¾½āĪö”æ½ā£ŗA”¢C”¢E”¢GŹĒ֊ѧ»Æѧ֊³£¼ūµÄµ„ÖŹ£¬Ķس£×“æöĻĀ£¬EŹĒĆܶČ×īŠ”µÄĘųĢ壬ŌņEĪŖH2 £¬ GŹĒ»ĘĀĢÉ«µÄĘųĢ壬ŌņGĪŖCl2 £¬ EÓėG·“Ӧɜ³ÉHĪŖHCl£¬B ŹĒ³£¼ūµÄĪŽÉ«ŅŗĢ壬FĪŖĒæ¼ī£¬ŌņAĪŖNa”¢BĪŖH2O”¢FĪŖNaOH£¬DŹĒijÖÖ¾ßÓŠ“ÅŠŌµÄ½šŹōæóĪļµÄÖ÷ŅŖ³É·Ö£¬KŹÜČČ·Ö½āæÉÉś³Éŗģ×ŲÉ«¹ĢĢ壬K·“Ó¦µĆµ½I£¬ŌņCĪŖFe”¢DĪŖFe3O4 £¬ ŃĪĖįÓėĖÄŃõ»ÆČżĢś·“Ӧɜ³ÉĀČ»ÆŃĒĢś”¢ĀČ»ÆĢś£¬¶ųIÄÜÓėFe·“Ó¦µĆµ½G£¬GÓėĀČĘų·“Ó¦µĆµ½I£¬ŌņIĪŖFeCl3”¢GĪŖFeCl2 £¬ KĪŖFe£ØOH£©3 £¬ ·ūŗĻ×Ŗ»Æ¹ŲĻµ£®
£Ø1.£©DµÄ»ÆѧŹ½ĪŖFe3O4 £¬ ¹Ź“š°øĪŖ£ŗFe3O4£»
£Ø2.£©HĪŖHCl£¬µē×ÓŹ½ĪŖ ![]() £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ ![]() £»
£»
£Ø3.£©AÓėB·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ2Na+2H2O=2NaOH+H2”ü£¬¹Ź“š°øĪŖ£ŗ2Na+2H2O=2NaOH+H2”ü£»
£Ø4.£©³£ĪĀĻĀĀČĘųÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗCl2+2OH©=Cl©+ClO©+H2O£¬¹Ź“š°øĪŖ£ŗCl2+2OH©=Cl©+ClO©+H2O£®
A”¢C”¢E”¢GŹĒ֊ѧ»Æѧ֊³£¼ūµÄµ„ÖŹ£¬Ķس£×“æöĻĀ£¬EŹĒĆܶČ×īŠ”µÄĘųĢ壬ŌņEĪŖH2 £¬ GŹĒ»ĘĀĢÉ«µÄĘųĢ壬ŌņGĪŖCl2 £¬ EÓėG·“Ӧɜ³ÉHĪŖHCl£¬B ŹĒ³£¼ūµÄĪŽÉ«ŅŗĢ壬FĪŖĒæ¼ī£¬ŌņAĪŖNa”¢BĪŖH2O”¢FĪŖNaOH£¬DŹĒijÖÖ¾ßÓŠ“ÅŠŌµÄ½šŹōæóĪļµÄÖ÷ŅŖ³É·Ö£¬KŹÜČČ·Ö½āæÉÉś³Éŗģ×ŲÉ«¹ĢĢ壬K·“Ó¦µĆµ½I£¬ŌņCĪŖFe”¢DĪŖFe3O4 £¬ ŃĪĖįÓėĖÄŃõ»ÆČżĢś·“Ӧɜ³ÉĀČ»ÆŃĒĢś”¢ĀČ»ÆĢś£¬¶ųIÄÜÓėFe·“Ó¦µĆµ½G£¬GÓėĀČĘų·“Ó¦µĆµ½I£¬ŌņIĪŖFeCl3”¢GĪŖFeCl2 £¬ KĪŖFe£ØOH£©3 £®


 ÓÅѧĆūŹ¦ĆūĢāĻµĮŠ“š°ø
ÓÅѧĆūŹ¦ĆūĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø²»·ūŗĻ¢÷A×åŌŖĖŲŠŌÖŹĢŲÕ÷µÄŹĒ
A.Ņ׊Ī³É£1¼ŪĄė×ÓB.“ÓÉĻµ½ĻĀŌ×Ó°ė¾¶Öš½„¼õŠ”
C.“ÓÉĻµ½ĻĀ·Ē½šŹōŠŌÖš½„¼õČõD.“ÓÉĻµ½ĻĀĒā»ÆĪļµÄĪČ¶ØŠŌŅĄ“Ī¼õČõ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ꏱ£¬NaOHŗĶNa2CO3Į½ČÜŅŗµÄpH¾łĪŖ12£®Į½ČÜŅŗÖŠ£¬ÓÉĖ®µēĄė³öµÄc£ØH+£©·Ö±šŹĒ”¢ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĢ½Ė÷ÉśĆüĻÖĻóÖŠµÄÓŠ¹ŲĪ¢¹Ū±ä»Æ£¬æĘѧ¼Ņ³£ŅŌ ![]() C±ź¼ĒµÄ»ÆŗĻĪļĪŖŹ¾×Ł¼Į£¬ĻĀĮŠ¹ŲÓŚ
C±ź¼ĒµÄ»ÆŗĻĪļĪŖŹ¾×Ł¼Į£¬ĻĀĮŠ¹ŲÓŚ ![]() CµÄĖµ·ØÖŠÕżČ·µÄŹĒ£Ø £©
CµÄĖµ·ØÖŠÕżČ·µÄŹĒ£Ø £©
A.ÖŹĮæŹżŹĒ6
B.ÖŹ×ÓŹżŹĒ6
C.µē×ÓŹżŹĒ14
D.ÖŠ×ÓŹżŹĒ14
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆѧÓĆÓļ±ķŹ¾ÕżČ·µÄŹĒ£Ø £©
A.Mg2+µÄ½į¹¹Ź¾ŅāĶ¼£ŗ 
B.ŅŅĖįµÄ½į¹¹¼ņŹ½£ŗCH3CH2OH
C.ĮņĖį¼ŲµÄµēĄė·½³ĢŹ½£ŗK2SO4ØTK2++SO ![]()
D.CO2µÄµē×ÓŹ½£ŗ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆĢ«ŃōÄÜ·Ö½āĖ®ÖĘĒā£¬Čō¹ā½ā0.02molĖ®£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.æÉÉś³ÉH2µÄÖŹĮæĪŖ0.02g
B.æÉÉś³ÉĒāµÄŌ×ÓŹżĪŖ2.408”Į1023øö
C.æÉÉś³ÉH2µÄĢå»żĪŖ0.224L£Ø±ź×¼Ēéæö£©
D.Éś³ÉH2µÄĮæĄķĀŪÉĻµČÓŚ0.04mol NaÓėĖ®·“Ó¦²śÉśH2µÄĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃŠ¾æ»Æѧ·“Ó¦ŌĄķ¶ŌÓŚÉś²ś”¢Éś»ī¼°»·¾³±£»¤¾ßÓŠÖŲŅŖŅāŅ唣Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©³£ĪĀĻĀ£¬ĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.1 mol”¤L-1µÄĖÄÖÖČÜŅŗ¢ŁNH4NO3 ¢ŚCH3COONa ¢Ū(NH4)2SO4 ¢ÜNa2CO3£¬pH“ӓ󵽊”ÅÅĮŠĖ³ŠņĪŖ_________________£ØĢīŠņŗÅ£©”£
£Ø2£©³£ĪĀĻĀ£¬Ļņ20 mL 0.2 mol”¤L-1 H2AČÜŅŗÖŠµĪ¼Ó0.2 mol”¤L-1 NaOHČÜŅŗ”£ÓŠ¹ŲĪ¢Į£ĪļÖŹµÄĮæ±ä»ÆČēĻĀĶ¼ĖłŹ¾”£
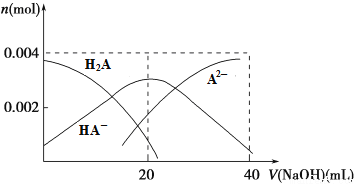
Ōņµ±v£ØNaOH£©£½20 mLŹ±£¬ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”¹ŲĻµ£ŗ________£¬Ė®µÄµēĄė³Ģ¶Č±Č“æĖ®________£ØĢī”°“ó”±”¢”°Š””±»ņ”°ĻąµČ”±£©”£
£Ø3£©ŗ¬ÓŠCr2O72-µÄ·ĻĖ®¶¾ŠŌ½Ļ“ó£¬Ä³¹¤³§·ĻĖ®ÖŠŗ¬5.0”Į10-3mol”¤L-1µÄCr2O72-”£ĪŖĮĖŹ¹·ĻĖ®µÄÅÅ·Å“ļ±ź£¬½ųŠŠČēĻĀ“¦Ąķ£ŗ
![]()
¢ŁøĆ·ĻĖ®ÖŠ¼ÓČėĀĢ·Æ£ØFeSO4”¤7H2O£©ŗĶH+£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ________________________”£
¢ŚČō“¦ĄķŗóµÄ·ĻĖ®ÖŠ²ŠĮōµÄc(Fe3+)=2.0”Į10-13mol”¤L-1£¬Ōņ²ŠĮōµÄCr3+µÄÅضČĪŖ___________”£(ŅŃÖŖ£ŗKsp[Fe(OH)3)]=4.0”Į10-38£¬ Ksp[Cr(OH)3]=6.0”Į10-31)
£Ø4£©ĄūÓĆ”°Na£CO2”±µē³Ų½«CO2±ä·ĻĪŖ±¦”£ĪŅ¹śæĘŃŠČĖŌ±ŃŠÖĘ³öµÄæɳäµē”° Na£CO2”±µē³Ų£¬ŅŌÄĘ²
ŗĶ¶ą±ŚĢ¼ÄÉĆ×¹Ü(MWCNT)ĪŖµē¼«²ÄĮĻ£¬×Ü·“Ó¦ĪŖ4Na£«3CO2 ![]() 2Na2CO3£«C”£·ÅµēŹ±øƵē³Ų”°ĪüČė”±CO2£¬Ę乤×÷ŌĄķČēĶ¼ĖłŹ¾£ŗ
2Na2CO3£«C”£·ÅµēŹ±øƵē³Ų”°ĪüČė”±CO2£¬Ę乤×÷ŌĄķČēĶ¼ĖłŹ¾£ŗ

¢Ł·ÅµēŹ±£¬Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ_____________________________”£
¢ŚČōÉś³ÉµÄNa2CO3ŗĶCČ«²æ³Į»żŌŚµē¼«±ķĆę£¬µ±×ŖŅĘ0.2 mol e£ Ź±£¬Į½¼«µÄÖŹĮæ²īĪŖ______g”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃé²Ł×÷ÓėŌ¤ĘŚŹµŃéÄæµÄ»ņĖłµĆŹµŃé½įĀŪŅ»ÖĀµÄŹĒ
Ń”Ļī | ŹµŃé²Ł×÷ŗĶĻÖĻó | Ō¤ĘŚŹµŃéÄæµÄ»ņ½įĀŪ |
A | ÓĆ½ą¾»µÄ²¬ĖæÕŗČ”Ä³Ź³ŃĪŹŌŃł£¬ŌŚ¾Ę¾«µĘ»šŃęÉĻ×ĘÉÕ£¬»šŃęĻŌ»ĘÉ« | ĖµĆ÷øĆŹ³ŃĪ²»ŹĒ¼ÓµāŃĪ |
B | Ņų°±ČÜŅŗÖŠµĪČėÉŁĮæ×é³ÉĪŖC2H4O2µÄŅŗĢ¬ÓŠ»śĪļ£¬Ė®Ō”Ī¢ČČ£¬ÓŠŅų¾µ³öĻÖ | æÉČ·¶ØøĆÓŠ»śĪļŅ»¶ØŹĒ¼×Ėį¼×õ„ |
C | ĻņĮ½Ö§Ź¢ÓŠKI3µÄČÜŅŗµÄŹŌ¹ÜÖŠ£¬·Ö±šµĪ¼Óµķ·ŪČÜŅŗŗĶAgNO3ČÜŅŗ£¬Ē°ÕßČÜŅŗ±äĄ¶£¬ŗóÕßÓŠ»ĘÉ«³Įµķ | KI3ČÜŅŗÖŠ“ęŌŚĘ½ŗā£ŗI3-=I2+I- |
D | ÅØĮņĖįÓėŅŅ“¼170”ę¹²ČČ£¬ÖʵƵÄĘųĢåĶØČėĖįŠŌøßĆĢĖį¼ŲČÜŅŗ£¬ČÜŅŗ×ĻÉ«ĶŹČ„ | ÖʵƵÄĘųĢå²śĪļĪŖŅŅĻ© |
A. A B. B C. C D. D
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com