
| m |
| M |
| n |
| V |
| n |
| c |
| 20g |
| 40g/mol |
| 0.5mol |
| 0.25L |
| 0.01mol |
| 0.1L |
| 1 |
| 2 |
| 0.005mol |
| 0.05mol/L |
| ||


科目:高中化学 来源: 题型:
| A、②⑤ | B、②⑤⑧ |
| C、①③④⑦ | D、②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属单质和酸反应一定放出氢气 |
| B、含金属元素的离子一定是阳离子 |
| C、金属阳离子被还原一定得到金属单质 |
| D、金属单质在化学反应中只作为还原剂失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有机物的熔点低,受热易分解,都能燃烧;有机物都是非电解质,不易导电 |
| B、有机物的化学反应比较复杂,一般较慢,且常伴有副反应发生 |
| C、沸点:正戊烷>2一甲基丁烷>2,2一二甲基丙烷 |
| D、同物质的量的物质完全燃烧耗O2量:已烷>环已烷>苯=苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
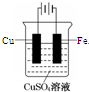
查看答案和解析>>
科目:高中化学 来源: 题型:
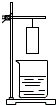 小华将一张滤纸在某指示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色.再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一盛有某溶液的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂和烧杯中的溶液分别是( )
小华将一张滤纸在某指示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色.再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一盛有某溶液的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂和烧杯中的溶液分别是( )| A | B | C | D | |
| 滤纸上的指示剂 | 酚酞试液 | 酚酞试液 | 石蕊试液 | 石蕊试液 |
| 烧杯中的溶液 | 浓氨水 | 浓盐酸 | 浓氨水 | 浓盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com