
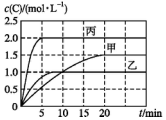
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间的变化关系分别以表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间的变化关系分别以表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10 min内甲容器中反应的平均速率v(A)=0.025 mol•L-1•min-1 | |
| B. | 由图可知:T1<T2,该反应为吸热反应 | |
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T2℃时,丙容器比乙容器反应快的原因是使用了催化剂 |
分析 A.结合v=$\frac{△c}{△t}$计算;
B.由图可知,乙比甲先达到平衡,可知T1<T2,且起始量相同,平衡时乙中C的浓度小,可知升高温度平衡逆向移动;
C.x=1,该反应为气体体积不变的反应;
D.乙、丙比较,丙中起始浓度为乙中2倍,浓度大反应速率大.
解答 解:A.10 min内甲容器中生成C为1.0mol/L,由v=$\frac{△c}{△t}$及速率之比等于化学计量数之比可知,v(A)=$\frac{1.0mo/L}{10min}$×$\frac{1}{2}$=0.05 mol•L-1•min-1,故A错误;
B.由图可知,乙比甲先达到平衡,可知T1<T2,且起始量相同,平衡时乙中C的浓度小,可知升高温度平衡逆向移动,则正反应为放热反应,故B错误;
C.x=1,该反应为气体体积不变的反应,则平衡时保持温度不变,改变容器体积平衡不移动,故C正确;
D.乙、丙比较,丙中起始浓度为乙中2倍,浓度大反应速率大,则T2℃时,丙容器比乙容器反应快的原因是丙中浓度大,故D错误;
故选C.
点评 本题考查物质的量浓度与时间变化曲线,为高频考点,把握图中浓度的变化、平衡移动为解答的关键,侧重分析与应用能力的考查,注意温度、浓度的判断,题目难度不大.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:多选题
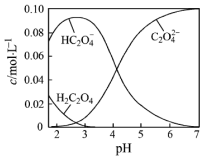 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )| A. | pH=7的溶液中:c(Na+)>2c(C2O42-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | c(HC2O4-)=c(C2O42-)的点的坐标为(4.3,0.5),则Na2C2O4的水解平衡常数为Kh=1×10-9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
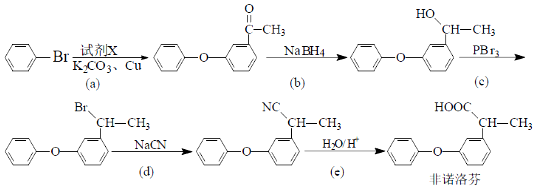
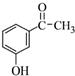 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、MgO熔点高,可用于制作耐高温仪器 | |
| B. | 纤维素属于多糖类物质,但不能作人类的营养物质 | |
| C. | 硝酸铵属于氧化剂,严禁用可燃物(如纸袋)包装 | |
| D. | 天然气是可再生清洁能源,可用于工业制盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
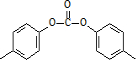
 ,流程如下
,流程如下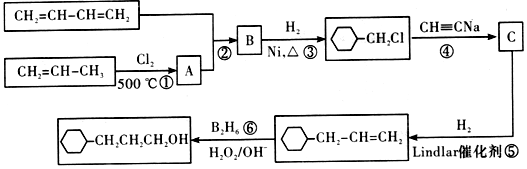
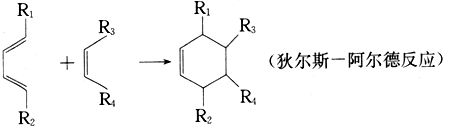
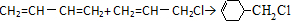
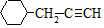
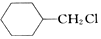 含有六元环且核磁共振氢谱有4组峰值的同分异构体的结构筒式
含有六元环且核磁共振氢谱有4组峰值的同分异构体的结构筒式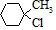
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法正确的是( )
常温下向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法正确的是( )| A. | HA为一元弱酸,MOH为一元强碱 | |
| B. | K点溶液中各微粒浓度大小关系,c(M+)>c(A-)>c(MOH)>c(OH-)>c(H+) | |
| C. | N点水的电离程度小于K点水的电离程度 | |
| D. | 若K点对应溶液的pH=10,则c(MOH)+c(OH-)=0.02mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线 | |
| C. | 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 | |
| D. | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ③④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池锌为负极,发生氧化反应 | |
| B. | 电池正极反应式为MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 当0.1mol Zn完全溶解时,电池外电路转移的电子个数约为1.204×1023 | |
| D. | 当该电池工作时,负极周围的pH值变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com