
【题目】下列反应的离子方程式书写正确的是
A. 碳酸钠溶液与石灰乳反应:CO32-+Ca2+=CaCO3↓
B. 硝酸银溶液与食盐水反应:Ag++Cl-=AgCl↓
C. 向NaOH溶液中通入过量的CO2:2OH-+CO2=CO32-+H2O
D. 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】KClO3 和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3 +4HCl(浓)→2KCl+2ClO2↑+Cl2↑+2H2O
(1)浓盐酸在反应中表现出来的性质是________________(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生 0.1molCl2,则转移电子的物质的量为________________mol.
(3)用单线桥法标出该反应的电子转移的方向和数目________________.
(4)ClO2 具有很强的氧化性,因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表 示)是 Cl2 的________________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用,其有效成分是( )
A. NaOH B. Na2O2 C. KMnO4 D. NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
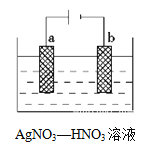
【题目】电解法在金属精炼、保护环境、处理废水中起着十分重要的作用。
(1)如图为电解精炼银的示意图,________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________。
(2)电解法处理酸性含铬废水(主要含有![]() )时,以铁板作阴、阳极,处理过程中存在反应
)时,以铁板作阴、阳极,处理过程中存在反应![]() +6Fe2++14H+
+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题:
2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题:
①写出电极反应式:阴极________________,阳极________________。
②当生成1 mol Cr(OH)3时,电路中转移电子的物质的量至少为________mol。
③电解过程中有Fe(OH)3沉淀生成,原因是______________________________________。
(3)电解降解法可用于治理水中硝酸盐的污染。电解降解![]() 的原理如图所示。
的原理如图所示。

①电源正极为________(填A或B),阴极反应式为______________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应(1)Cl2+ 2KBr==2KCl+ Br2,(2)Br2 + 2KI==2KBr +I2,判断单质的氧化性由强到弱的顺序是( )
A. Br2> I2> Cl2 B. Cl2 > Br2 > I2 C. Cl2 > I2 > Br2 D. Br2 > Cl2 > I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是短周期元素,原子半径的大小:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如下图所示转化关系,其中R为10电子分子,是一种常见的无机溶剂。下列说法不正确的是
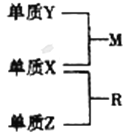
A. X元素位于周期表中的第16列
B. X的氢化物沸点一定高于Y的氢化物的沸点
C. X、Y、Z元素可以组成一种分子式为Z2Y2X4的化合物,其水溶液中水的电离受到了抑制
D. X、Y、Z元素两两之间均能形成原子个数比为1 : 1的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物a和苯通过反应合成b的过程可表示为下图(无机小分子产物略去)。下列说法正确的是
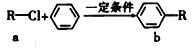
A. 该反应是加成反应
B. 若R为CH3时,b中所有原子可能共面
C. 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有12种
D. 若R为C4H5O时,lmol b最多可以与6mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s) ![]() BaS(s)+4CO(g) ΔH=+571.2 kJ·mol1
BaS(s)+4CO(g) ΔH=+571.2 kJ·mol1
BaS(s) ![]() Ba(s)+S(s) ΔH=+460 kJ·mol1
Ba(s)+S(s) ΔH=+460 kJ·mol1
已知:2C(s)+O2(g) ![]() 2CO(g) ΔH=221 kJ·mol1
2CO(g) ΔH=221 kJ·mol1
则:Ba(s)+S(s)+2O2(g) ![]() BaSO4(s) ΔH=_____________。
BaSO4(s) ΔH=_____________。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度部分图象如图:
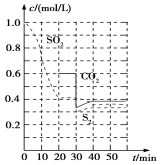
①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③40 min时,平衡常数K=________。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是________(填序号)。
a.c(Na+)+c(H+)>c(![]() )+c(
)+c(![]() )+c(OH)
)+c(OH)
b.水电离出c(H+)=1×108 mol/L
c.c(Na+)>c(![]() )>c(H+)>c(
)>c(H+)>c(![]() )
)
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加____mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 常温常压下,1.06 g Na2CO3溶于水含有的Na+离子数为0.02 NA
C. 通常状况下,NA个CO2分子占有的体积为22.4 L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com