
����Ŀ�����ݷ�Ӧ��2Na2CO3+SnO2+4S![]() Na2SO4+Na2SnS3+2CO2���ش��������⣺
Na2SO4+Na2SnS3+2CO2���ش��������⣺
��1��������Ӧ�漰��Ԫ���У��ǽ�������ǿ��Ԫ�����������Ų�ʽΪ_____��
��������Ӧ���������У����ڷ��Ӿ���Ļ�����ĽṹʽΪ_____��
��2����������Ӧ�е������ʵ�ԭ�Ӻ����_____�ֲ�ͬ�˶�״̬�ĵ��ӣ���_____�ֲ�ͬ�����ĵ��ӡ�
��3��������Ӧ�У���������ǿ��Ԫ������Ԫ����Ƚϣ�������Ϊ�ж����߽�����ǿ�����ݵ���_____��ѡ���ţ���
a���ܷ��û�������ͭ��Һ�е�ͭ����
b��Al(OH)3�ܷ��ܽ��ڸ�Ԫ������������Ӧ��ˮ������
c����������������ʱʧȥ������Ŀ�Ķ���
d��������ͬŨ�ȵ�ϡ���ᷢ����Ӧ�ľ��ҳ̶�
��4��������Ӧ���������뻹ԭ�������ʵ���֮����_____��
��5�������£����Na2SnS3��ҺpH��7���������ӷ���ʽ������ԭ��_____
���𰸡�2s22p4 O��C��O 16 5 bd 3��1 SnS32��+H2OHSnS3��+OH��
��������
��1������Ԫ�������ڱ��е�λ�ÿ�֪���ǽ���Ԫ��ǿ��˳����O��S��C��
��2��ԭ�Ӻ����ж��ٸ����Ӿ��ж������˶�״̬���ж������ܼ����ж����ֲ�ͬ�����ĵ��ӣ�
��3��������Ӧ�н�������ǿ��Ԫ�����ƣ�������ǿ�����жϷ����У����������û������������׳̶ȡ�����֮����û���Ӧ����������������ˮ�������ǿ����
��4���÷�Ӧ��SԪ�ػ��ϼ���0�۱�Ϊ+6�ۺ�-2�ۣ�S�������������ǻ�ԭ����
��5��Na2SnS3��ҺpH��7��˵��Na2SnS3Ϊǿ�������Σ����������ˮ�����Һ�ʼ��ԣ�
��1���÷�Ӧ�зǽ���Ԫ��ǿ��˳����O��S��C�����Էǽ�������ǿ��Ԫ����OԪ�أ����������ӷֱ�λ��2s��2p�ܼ�����۵����Ų�ʽΪ2s22p4���÷�Ӧ�����ڷ��Ӿ���Ļ������Ƕ�����̼��������̼������ÿ��Oԭ�Ӻ�Cԭ���γ��������õ��Ӷԣ���ṹʽΪO��C��O��
��2��ԭ�Ӻ����ж��ٸ����Ӿ��ж������˶�״̬��SԪ��ԭ�Ӻ�����16�����ӣ�����Sԭ�Ӻ��������16���˶�״̬���ж������ܼ����ж����ֲ�ͬ�����ĵ��ӣ�Sԭ�Ӻ�����1s��2s��2p��3s��3p�����ܼ������������ֲ�ͬ�����ĵ��ӣ�
��3��a����������ˮ��Ӧ�������û�������ͭ��Һ�е�ͭ�����ܻ�������ͭ��Һ�е�ͭ�����ܱȽ��ƺ����Ľ�����ǿ�����ʲ�ѡa��
b��Al(OH)3���ܽ�������������Һ�У�˵�����������ļ���С��NaOH�������ܾݴ��жϽ�����ǿ������ѡb��
c����������������ʱʧȥ������Ŀ�Ķ��������������ǿ���أ��ʲ�ѡc��
d��������ͬŨ�ȵ�ϡ���ᷢ����Ӧ�ľ��ҳ̶����жϽ�����ǿ������ѡd��
��4���÷�Ӧ��SԪ�ػ��ϼ���0�۱�Ϊ+6�ۺͩ�2�ۣ�S�������������ǻ�ԭ�������������ͻ�ԭ�������ʵ���֮����3��1��
��5��Na2SnS3Ϊǿ�������Σ����������ˮ�����Һ�ʼ��ԣ���ˮ�ⷽ��ʽΪSnS32��+H2OHSnS3��+OH����


 ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������е�NO����O3Ԥ����������CaSO3����Һ����ȥ����Ԥ����ʱ������Ӧ��NO(g)��O3(g)![]() NO2(g)��O2(g)����ã�v����k��c(NO)��c(O3)��v����k��c(NO2)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣���ݻ���Ϊ2L�ļס��������ܱ������г���һ������NO��O3�����NO�����������ʱ��ı仯��ͼ��ʾ������˵����ȷ����(����)
NO2(g)��O2(g)����ã�v����k��c(NO)��c(O3)��v����k��c(NO2)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣���ݻ���Ϊ2L�ļס��������ܱ������г���һ������NO��O3�����NO�����������ʱ��ı仯��ͼ��ʾ������˵����ȷ����(����)
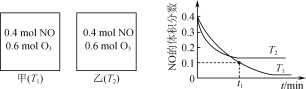
A.�������������������NO��ƽ��ת����
B.T1ʱ����Ӧ��t1min�ڵ�ƽ������v(O2)��![]() mol��L��1��min��1
mol��L��1��min��1
C.T1ʱ��NO(g)��O3(g)![]() NO2(g)��O2(g)��k����3k��
NO2(g)��O2(g)��k����3k��
D.T2ʱ����2L�ܱ������г���0.6molNO��0.4molO3������ƽ��ʱc(NO2)С����������ƽ��ʱc(NO2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧ��ʵ�飬�ܴﵽʵ��Ŀ�ĵ��ǣ� ��
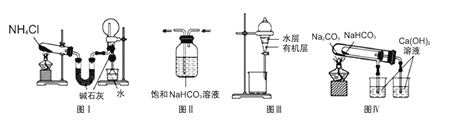
A.ͼI����ʵ������ȡ�������ռ�����İ���
B.ͼII���ڳ�ȥCO2�к��е�����HCl
C.ͼIII������ȡI2��CCl4��Һ�е�I2
D.ͼIVװ��������֤NaHCO3��Na2CO3�����ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ƭ��ϩ�������һ��̫���ܴ��ܲ��ϣ�����Ƭ��ϩ�������������¿��Է�������ת��������˵���������

A.�Ļ����һ�ȴ��ﳬ������(�����������칹)
B.����Ƭ��ϩ��ʹ���Ը��������Һ��ɫ
C.����Ƭ��ϩ���Ļ��黥Ϊͬ���칹��
D.����Ƭ��ϩ������λ��ͬһƽ���̼ԭ�Ӳ�����4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����������е㣺117.2�棬����ȩ�е㣺75.7�棻���������ϳ�����ȩ�ķ�Ӧ��![]() ��װ����ͼ������˵������ȷ����
��װ����ͼ������˵������ȷ����

A.Ϊ��ֹ�����һ��������Ӧ������Na2Cr2O7������Һ��μ�����������
B.��������������м������������ƣ��ɼ��������Ƿ���������
C.���¶ȼ�1ʾ��Ϊ90��95�棬�¶ȼ�2ʾ����76������ʱ�ռ�����
D.��������õĴ�����ȩ�У�������ˮCaCl2���壬���ˣ������ᴿ����ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����֤�������ʵ���ʵ�飬a��b��d��e�ǽ��������Һ����ֽ����KMnO4����μ�һ��Ũ�������������һ������������档��֪��2KMnO4��16HCl�D��2KCl��5Cl2����2MnCl2��8H2O
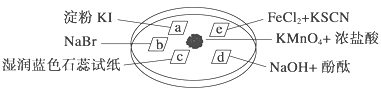
��ʵ������������ͻ��������ȷ���� (����)
ѡ�� | ʵ������ | ���ͻ���� |
A | a��������b�������ɫ | �����ԣ�Cl2>Br2>I2 |
B | c���ȱ�죬����ɫ | ������ˮ�������������� |
C | d��������ɫ | ������ˮ������Ư�������� |
D | e�����ɫ | ��ԭ�ԣ�Fe2��>Cl�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ƽ������������һ�ֵ��װ�ã��ܽ�����(C3H8O3)�Ͷ�����̼ת��Ϊ����ȩ(C3H6O3)�ͺϳ�����ԭ����ͼ��ʾ������˵����ȷ����
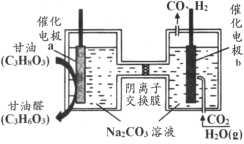
A.���缫b���Դ��������
B.���ʱ���缫a������pH����
C.���ʱ������������Ĥ��a��Ǩ��
D.���ɵĸ���ȩ��ϳ��������ʵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�����һ�����������Ͻ����ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һx�У���μ���4molL��1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���������йؼ�����ж���ȷ���ǣ�������
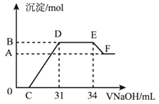
A.��Һx���������������У�Al3+��H+��Fe3+��Fe2+
B.��DE�Σ�������Ӧ�����ӷ���ʽΪNH4++OH����NH3H2O
C.�����B���Ӧ�ij��������ʵ���
D.C���Ӧ������������Һ�����Ϊ7mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ̽�����ں���a g HNO3��ϡ�����У�����b g���۳�ַ�Ӧ����ȫ���ܽⲢ����NO����a/4 g HNO3����ԭ����a��b������Ϊ (����)
A. 2��1 B. 3��1 C. 4��1 D. 9��2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com