
【题目】某反应使用催化剂后,其反应过程中能量变化如图所示。下列说法错误的是
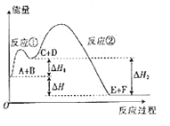
A. △H=△H1-△H2
B. 该反应的总反应为放热反应
C. 使用催化剂,不能改变反应进行的方向
D. 反应①是吸热反应,反应②是放热反应
【答案】A
【解析】
由图可知,反应物总能量低于生成物总能量,则A和B反应生成C和D的反应为吸热反应;反应物总能量高于生成物总能量,则C和D反应生成E和F的反应为放热反应,总反应A和B反应生成E和F的反应为放热反应,反应热△H=△H2-△H1。
A项、由图可知,A和B反应生成E和F的反应为放热反应,反应热△H=△H2-△H1,故A错误;
B项、反应物总能量高于生成物总能量,则总反应A和B反应生成E和F的反应为放热反应,故B正确;
C项、使用催化剂,能改变反应反应活化能,能改变反应的反应速率,不能改变反应进行的方向,故C正确;
D项、由图可知,反应物总能量低于生成物总能量,则A和B反应生成C和D的反应为吸热反应;反应物总能量高于生成物总能量,则C和D反应生成E和F的反应为放热反应,故D正确。
故选A。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】右图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 其能量转化的形式主要是“化学能→电能→光能”
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是
A. 沸点:新戊烷>2,2-二甲基戊烷>丙烷
B. 密度:CCl4>H2O>甲苯
C. 等质量的物质燃烧耗O2量:乙烷>乙烯>乙炔>甲烷
D. 等物质的量物质燃烧耗O2量:环己烷>苯>苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水合硫酸铜可用作杀菌剂等。
(1)基态Cu2+的核外电子排布式为____________。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
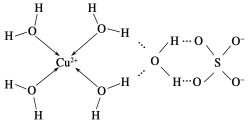
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42-的立体构型名称为________,H2O的VSEPR模型名称为____。
(3)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______________________。
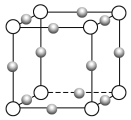
(4)Cu3N形成的晶体结构如下图所示,N3-的配位数是______。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为______________(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,不能说明反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)达到平衡状态的是
2NH3(g)+CO2(g)达到平衡状态的是
A. 混合气体的密度不再发生变化
B. 混合气体的总物质的量不再发生变化
C. 混合气体的平均相对分子质量不再发生变化
D. 混合气体的压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲班学生做完实验室制备氧气和还原金属氧化物的实验后,剩余物质倒入同一废液缸里。乙班课外兴趣小组同学进行了如图所示的探究。请回答:
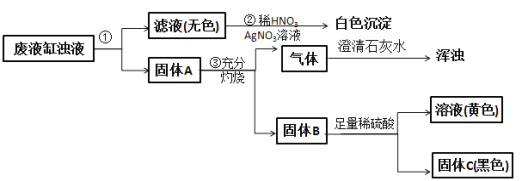
(1)步骤①的操作名称是___________,所用到的玻璃仪器有漏斗、玻璃棒和___________。
(2)由步骤②实验现象推知,甲班同学制取氧气所用的固体反应物是___________(写化学式)。
(3)由步骤④所得溶液加入氢氧化钠可得红棕色沉淀,该反应的化学方程式为______________________。
(4)由步骤③产生的气体判断固体A中一定含有___________(写名称);综合步骤③④现象推理,固体A中还可能含有的物质是______________________(写至少两种物质的化学式)。
(5)根据上述实验和分析判断固体C是___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是
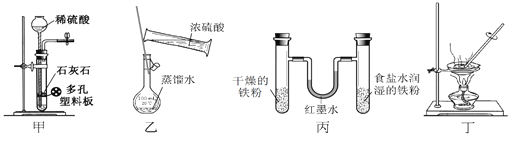
A. 甲用于实验室制取少量CO2 B. 乙用于配制一定物质的量浓度的硫酸
C. 丙用于模拟生铁的电化学腐蚀 D. 丁用于蒸干A1Cl3溶液制备无水AlC13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。需用托盘天平称量___g的氢氧化钠固体。
取20.00mL待测盐酸放入锥形瓶中,并滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是_________
②根据上述数据,可计算出该盐酸的浓度约为______。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。(双选)
A 滴定终点读数时俯视读数 B 酸式滴定管使用前,水洗后未用待测盐酸润洗
C 锥形瓶水洗后未干燥 D 碱式滴定管尖嘴部分有气泡,滴定后消失
E 称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是_____
A 溶液呈中性,可选用甲基橙或酚酞作指示剂
B 溶液呈中性,只能选用石蕊作指示剂
C 溶液呈碱性,可选用甲基橙或酚酞作指示剂
D 溶液呈碱性,只能选用酚酞作指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com