
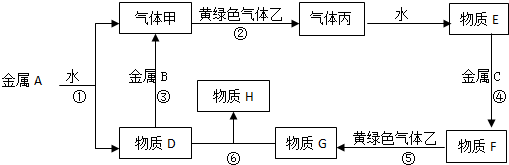
分析 金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,A能和水反应生成气体和D,A的焰色反应呈黄色,则A是Na,甲是H2、D是NaOH,灰绿色气体是Cl2,则乙是Cl2;气体丙为HCl,E是盐酸,NaOH和金属B反应生成氢气,则B为Al;盐酸和金属C反应生成F,F能被氯气氧化生成G,G能和NaOH反应生成H,金属C为变价金属,则C为Fe,F为FeCl2、G为FeCl3,H为Fe(OH)3,据此分析解答.
解答 解:金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,A能和水反应生成气体和D,A的焰色反应呈黄色,则A是Na,甲是H2、D是NaOH,灰绿色气体是Cl2,则乙是Cl2;气体丙为HCl,E是盐酸,NaOH和金属B反应生成氢气,则B为Al;盐酸和金属C反应生成F,F能被氯气氧化生成G,G能和NaOH反应生成H,金属C为变价金属,则C为Fe,F为FeCl2、G为FeCl3,H为Fe(OH)3,
(1)通过以上分析知,B、G分别是Al、FeCl3,故答案为:Al;FeCl3;
(2)反应①为钠和水的反应,反应方程式为2Na+2H2O═2NaOH+H2↑,
反应⑤为氯气和氯化亚铁的反应生成氯化铁,反应方程式为2FeCl2+Cl2═2FeCl3,
反应⑥为氯化铁和NaOH的复分解反应,反应方程式为FeCl3+3NaOH═Fe(OH)3↓+3NaCl,
故答案为:2Na+2H2O═2NaOH+H2↑;2FeCl2+Cl2═2FeCl3;FeCl3+3NaOH═Fe(OH)3↓+3NaCl.
点评 本题以Fe、Al及其化合物之间的转化为载体考查无机物推断,为高频考点,侧重考查学生分析判断能力,以物质特殊颜色、特殊性质为突破口进行推断,熟练掌握元素化合物之间的转化,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原电池的负极发生氧化反应,原电池在工作时负极一定溶解 | |
| B. | 以KOH溶液为电解质溶液的甲烷燃料电池工作时,OH-离子从正极移向负极,电解质溶液的PH增大 | |
| C. | 以两个铜棒为电极电解硫酸溶液,在阴极上发生还原反应,且始终是H+在阴极放电生成H2 | |
| D. | 反应2Ag+2HCl═2AgCl+H2↑在电解的条件下可以发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | X的最高价氧化物对应水化物的酸性比W的弱 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | W的气态简单氢化物的热稳定性比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的和操作 | 影响结果 | 原因分析 |
| A | 将2g I2加入到98mLCCl4中溶解混匀后,配制质量分数为2% I2的CCl4溶液 | 偏小 | CCl4的密度大于1g•mL-1 |
| B | 用10mL的量筒测量酯化反应得到乙酸乙酯的体积,俯视液面读出数据为6.0mL | 偏小 | 平视读取应大于6.0mL |
| C | 配制2mol•L-1NaCl溶液,定容时加入的水超过了刻度线,立即用滴管吸出多余的水,再摇匀 | 无影响 | 吸出了多余的水 |
| D | 用尖嘴有气泡的碱式滴定管盛标准NaOH溶液滴定20.00mL某待测HCl溶液的浓度 | 偏大 | 流出碱液的量 变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| B. | 1 molFe与足量的Cl2反应转移的电子数为2NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 标准状况下,22.4 LSO3含有的原子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )
头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )| A. | 其分子式可以表示为C15H16ClN3O6S | |
| B. | 该物质具有两性 | |
| C. | 1 mol该化合物与NaOH溶液作用时消耗NaOH的物质的量最多为 4 mol | |
| D. | 该物质遇FeCl3溶液显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| B. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| C. | 绿色化学反应选择的原料、催化剂、溶剂都应该是无毒无害的 | |
| D. | 乙烯分别与溴水和溴的四氯化碳溶液反应制备1,2-二溴乙烷的原子利用率均为100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com