
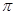 键有 mol。
键有 mol。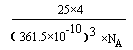 (2分)
(2分)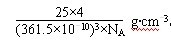 。
。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。| A.NH3分子中N原子采用sp3杂化 |
| B.相同压强时,NH3沸点比PH3高 |
| C.[Cu (NH3)4]2+离子中,N原子是配位原子 |
| D.CN-的电子式为[:C┇┇N:]- |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| X | X元素形成的一种同素异形体是天然晶体中硬度最大的单质 |
| Y | 常温常压下,Y单质是淡黄色固体,用于制造黑火药 |
| Z | Z的基态原子核外有3个能级上有电子,且有3个单电子 |
| W | W元素形成的双原子分子,常温下为黄绿色气体,一种常见工业原料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
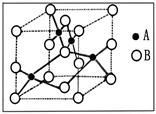
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com