
| һ������ |
| 3.2g |
| 160g/mol |
| ||
| 1min |
| 0.020L��0.01mol/L |
| 0.020L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
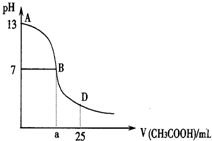 ��ͼΪ��25mL 0.1mol?L-1NaOH��Һ����εμ�0.2mol?L-1CH3COOH��Һ��������ҺpH�ı仯���ߣ���ش�
��ͼΪ��25mL 0.1mol?L-1NaOH��Һ����εμ�0.2mol?L-1CH3COOH��Һ��������ҺpH�ı仯���ߣ���ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH=3��CH3COOH��Һ��Ũ��С��pH=2�������Ũ�� |
| B����NaHCO3��Һ�м�������NaOH���壬������HCO3-��ˮ�⣬ʹc��HCO3-������ |
| C������������CH3COOH��Һ��NaOH��Һ��ϣ�������Һ�����ڣ�c��Na+��+c��H+��=c��CH3COO-��+c��OH-�� |
| D��Na2CO3��Һ�У�c��Na+����c��CO32-����c��OH-��=c��HCO3-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| t/s | 0 | 5 | 15 | 25 | 35 |
| n��A��/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A����Ӧ��ǰ5 s��ƽ������v��A��=0.17mol?L-1?s-1 |
| B�����������������䣬�����¶ȣ�ƽ��ʱc��A��=0.41mol?L-1����Ӧ�ġ�H��0 |
| C����ͬ�¶��£���ʼʱ�������г���0.20molA��0.20molB��1.0molC����Ӧ�ﵽƽ��ǰv��������v���棩 |
| D����ͬ�¶��£���ʼʱ�������г���2.0 molC�ﵽƽ��ʱ��C��ת����С��80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ڢ� | B���٢ۢ� |
| C���ڢۢ� | D��ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
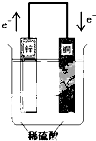
| A��ͭƬ���д������ݲ��� |
| B��ͭƬ�Ϸ���������Ӧ |
| C��пƬΪ���� |
| D����װ�ý���ѧ��ת��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����»�ѧ��Ӧ��2A��g��+B��g��?2C��g������H��0��
�����»�ѧ��Ӧ��2A��g��+B��g��?2C��g������H��0���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com