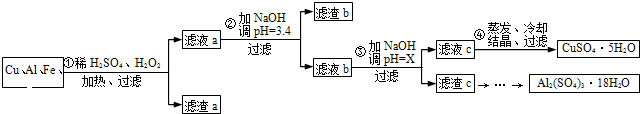
信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾.某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Cu(OH)2 |
| 开始沉淀物 |
1.1 |
4.0 |
5.4 |
| 完全沉淀物 |
3.2 |
5.2 |
6.7 |
(1)过滤操作中用到的玻璃仪器有
烧杯、漏斗、玻璃棒
烧杯、漏斗、玻璃棒
.
(2)Cu可溶于稀硫酸与H
2O
2的混合溶液,其离子方程式是
Cu+H2O2+2H+═Cu2++2H2O
Cu+H2O2+2H+═Cu2++2H2O
.
(3)滤渣a的主要成分是
Au
Au
.
(4)步骤③中X的取值范围是
5.2≤X<5.4
5.2≤X<5.4
.
(5)某小组甲同学提出如下方案测定CuSO
4?5H
2O晶体的纯度.取b g试样配成100m L溶液,每次取20.00m L,消除干扰离子后,用c mol?L
-1EDTA(H
2Y
2-)标准溶液滴定至终点,平均消耗EDTA溶液12.00m L.滴定反应如下:Cu
2++H
2Y
2-═CuY
2-+2H
+.
①写出计算CuSO
4?5H
2O质量分数的表达式w=
.
②下列操作会导致CuSO
4?5H
2O含量的测定结果偏高的是
c
c
(填字母).
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡c.未除净可与EDTA反应的干扰离子
③该小组乙同学提出通过直接测定样品中SO
42一的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是
样品中的杂质Na2SO4中也含有SO42-
样品中的杂质Na2SO4中也含有SO42-
.