
| A. | 0.5mol•L-1的NaHSO3溶液与1.0mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ | |
| B. | 向Ca(HCO3)2溶液中加入足量的澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
分析 A.次氯酸根具有强氧化性,亚硫酸氢根具有还原性,二者发生氧化还原反应,由于NaClO过量,溶液中氢离子与次氯酸根结合为HClO;
B.碳酸氢钙与氢氧化钙反应生成碳酸钙与水;
C.氢氧化铁与HI发生中和反应,反应得到铁离子具有强氧化性,可以氧化碘离子为碘单质;
D.反应本质是过氧化钠与水反应生成氢氧化钠与过氧化氢,过氧化氢再分解生成水以氧气.
解答 解:A.次氯酸根具有强氧化性,亚硫酸氢根具有还原性,二者发生氧化还原反应,NaHSO3、NaClO的物质的量之比为1:2,发生氧化还原反应时NaClO过量,溶液中氢离子与次氯酸根结合为HClO,反应离子方程式为:HSO3-+2ClO-═SO42-+Cl-+HClO,故A错误;
B.碳酸氢钙与氢氧化钙反应生成碳酸钙与水,反应离子方程式为:Ca2++HCO3-+OH-═CaCO3↓+H2O,故B错误;
C.氢氧化铁与HI发生中和反应,反应得到铁离子具有强氧化性,可以氧化碘离子为碘单质,离子方程式为:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O,故C正确;
D.反应本质是过氧化钠与水反应生成氢氧化钠与过氧化氢,过氧化氢再分解生成水以氧气,反应离子方程式为:4H218O+2Na2O2═4Na++4 18OH-+2H2O+O2↑,故D错误,
故选:C.
点评 本题考查离子方程式掌握判断,AD选项为易错点,A中学生容易忽略次氯酸钠与酸反应得到HClO,D选项中关键是明确反应本质,难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
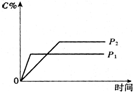 温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )
温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )| A. | P1>P2,n<3 | B. | P1<P2,n=3 | C. | P1<P2,n>3 | D. | P1>P2,n>3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是良好的半导体材料 | |
| B. | 光导纤维中成分和沙子中的主要成分相同 | |
| C. | 用通入澄清石灰水的方法可以区分出CO2和SO2气体 | |
| D. | SO2的漂白原理与木炭、过氧化钠及湿润氯气的漂白原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液B中发生的反应为:2SO2+O2→2SO3 | |
| B. | 由反应过程可推知氧化性:O2>Fe3+>SO42- | |
| C. | 溶液的pH:A>B>C | |
| D. | A溶液到C溶液,Fe3+浓度变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com