
用铂作电极电解1000 mL 0.1 mol/L AgNO3溶液,通电一段时间后关闭电源,测得溶液的质量减少了13.4 g。下列有关叙述正确的是(NA代表阿伏加德罗常数的值)
A.电解过程中流经外电路的电子数目为0.1NA
B.在标准状况下,两极共产生3.92L气体
C.电解后溶液的pH为2(假设溶液体积不变)
D.加入13.8 g Ag2CO3可将溶液彻底复原
B
【解析】
试题分析:电解AgNO3溶液的方程式是:4AgNO3+ 2H2O 4Ag+O2↑+4HNO3。n(AgNO3)=0.1mol,若AgNO3完全电解完全,则电子转移的物质的量是0.1mol,减轻的质量是10.8g+1/4×3.2g=11.6g。现在溶液的质量减少了13.4 g>11.6g,说明后来还有水发生电离,2H2O
4Ag+O2↑+4HNO3。n(AgNO3)=0.1mol,若AgNO3完全电解完全,则电子转移的物质的量是0.1mol,减轻的质量是10.8g+1/4×3.2g=11.6g。现在溶液的质量减少了13.4 g>11.6g,说明后来还有水发生电离,2H2O 2H2↑+O2↑。n(H2O)= (13.4 g—11.6g) ÷ 18g/mol==0.1mol。则电子的物质的量是0.1mol+0.1mol×2=0.3mol,数目是0.3NA,错误;B.在标准状况下,阳极产生的气体的体积是[(0.1mol÷4+0.05mol)]×22.4L/mol=1.68L,阴极产生的气体的体积是0.1mol×22.4L/mol= 2.24L,所以气体的总体积是V=1.68L+ 2.24L=3.92L,故选项B正确;C.电解后溶液是硝酸溶液,n(HNO3)=0.1mol,V=1L。所以c(H+)=0.1mol/L,所以溶液的pH为1,错误;D.电解后由于产生0.1mol的银、0.075mol、0.1mol的氢气。所以加入13.8 g Ag2CO3不可将溶液彻底复原,错误。
2H2↑+O2↑。n(H2O)= (13.4 g—11.6g) ÷ 18g/mol==0.1mol。则电子的物质的量是0.1mol+0.1mol×2=0.3mol,数目是0.3NA,错误;B.在标准状况下,阳极产生的气体的体积是[(0.1mol÷4+0.05mol)]×22.4L/mol=1.68L,阴极产生的气体的体积是0.1mol×22.4L/mol= 2.24L,所以气体的总体积是V=1.68L+ 2.24L=3.92L,故选项B正确;C.电解后溶液是硝酸溶液,n(HNO3)=0.1mol,V=1L。所以c(H+)=0.1mol/L,所以溶液的pH为1,错误;D.电解后由于产生0.1mol的银、0.075mol、0.1mol的氢气。所以加入13.8 g Ag2CO3不可将溶液彻底复原,错误。
考点:考查电解原理的应用的知识。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
将一定量的H2、CO和CO2的混合气体通入盛有足量Na2O2粉末(Na2O2体积忽略不计)的密闭容器中,用电火花引燃直至反应完全。恢复到原温度,容器内的压强为原来的1/4,则原混合气体的平均相对分子质量可能是
A.20 B.23 C.30 D.36
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
有关元素及其化合物的化学用语正确的是
A.CO2的电子式: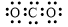
B.NaClO的结构式:Na—O—Cl
C.醋酸钠的分子式:C2H3O2Na
D.乙烯的比例模型:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:选择题
2013年7月23日,央视记者分别在北京崇文门附近的麦当劳、肯德基以及真功夫3家大型快餐店取回可食用冰块进行抽样检测。检测结果显示:3家快餐店食用冰块菌落总数严重超标。下列说法正确的是
A.肉毒杆菌有毒,可在其中加入硫酸铜使其变性后食用
B.肉毒杆菌在体内水解生成的氨基酸不能成为人体重要的营养物质
C.大肠杆菌分子中不一定含羧基和氨基
D.出血性大肠杆菌和油脂均为能水解的高分子化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况)
B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL
C.原稀硝酸的物质的量浓度一定为4 mol/L
D.参加反应金属总质量(m)为9.6g>m>3.6g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
下列有关溶液组成的描述合理的是
A.在Fe2(SO4)3溶液中可以大量存在: K+、Fe2+、Cl-、Br-、SCN-
B.c(H+)=1×10-13mol/L的溶液中可以大量存在:Mg2+、Cu2+、HCO3-、NO3-
C.加水稀释时c(OH-)/c (H+)值增大的溶液中可大量存在:MnO4-、CO32-、K+、NH4+
D.在碱性溶液中可以大量存在:S2O32- 、AlO2-、SiO32-、S2- 、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第四次模拟考试理综化学试卷(解析版) 题型:实验题
(20分)实验室中,用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁( —
—
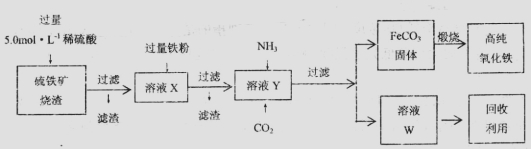
Fe2O3)的步骤如下:
回答下列问题:
(1)上述实验中,加入铁粉的作用是____________。(用离子方程式表示)实验中检验溶液x中的离子是否与铁粉完全反应的试剂是____________溶液
(2)实验室欲用18.4 mol·L-1。的浓硫酸配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有_________(填写仪器名称);
(3)某同学用下图所示装置实现向溶液Y中通入NH3和CO2
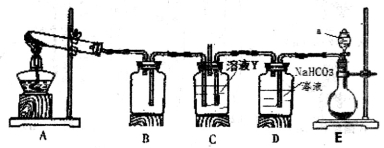
①上述装置的中,仪器a的名称是_______;装置B的作用是____________________。
②圆底烧瓶内放置的固体药品为________(填化学式);试管内发生反应的化学方程式为_________________。
③甲、乙、丙三位同学分别用上述装置进行实验,装置C的试剂瓶内溶液体积相等。
若甲、乙两同学实验中,通入的NH3和CO2的物质的量之比分别为2:l和l:l,恰好完全反应后,溶液中水的电离程度 ________(填“>”“=”或“<”)
________(填“>”“=”或“<”)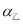 。
。
若丙同学未用装置D,则反应后溶液中离子浓度间的关系为[H+]+[NH4+]=_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省曲阜市高三上学期期中考试化学试卷(解析版) 题型:选择题
用如图装置进行实验,将液体A逐滴加人到固体B中,下列叙述正确的是

A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中熔液最终呈红色
B.实验仪器D可以起到防止溶液倒吸的作用
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4.B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三12月学情调研化学试卷(解析版) 题型:实验题
(15分)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2?6H2O的流程如下:
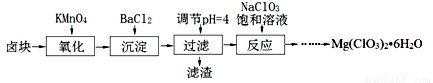
已知:
①卤块主要成分为MgCl2?6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。
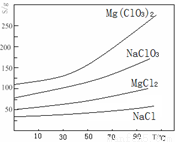
(1)“调节pH=4”可选用的试剂是 (填编号)。
①MgO ②CuO ③MgCO3 ④Mg
(2)加入BaCl2的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是 。
(3)“滤渣”的主要成分为 。
(4)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═===Mg(ClO3)2+2NaCl,再进一步制取Mg(ClO3)2?6H2O的实验步骤依次为:①蒸发、浓缩、结晶;② ;③ ;④过滤、洗涤、干燥。
(5)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是 。
(6)产品中Mg(ClO3)2?6H2O含量的测定:
步骤1:准确称量3.00g产品配成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol?L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol?L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
①写出步骤2中发生反应的离子方程式: 。
②产品中Mg(ClO3)2?6H2O的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com